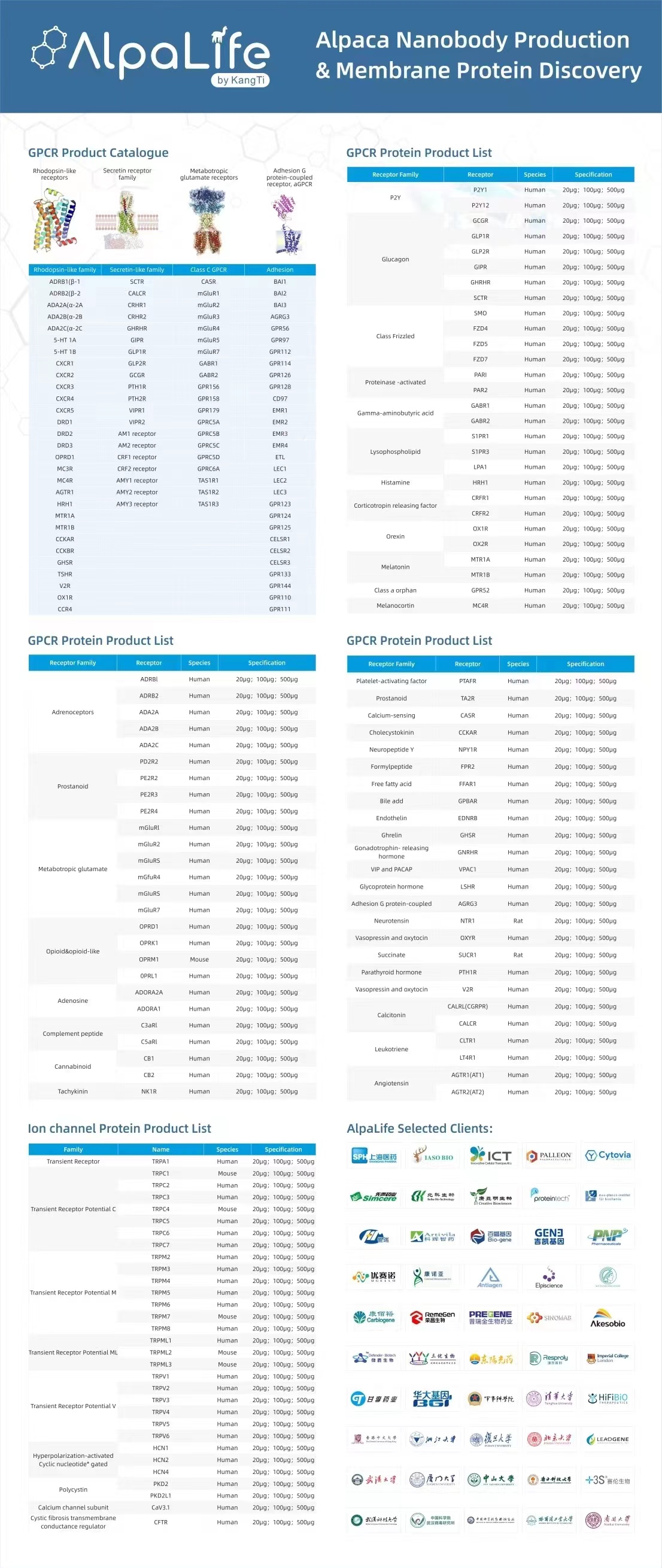
明星药物靶点蛋白——GPCR
当前约50%的上市药物作用于GPCR,但是在800多个GPCR成员里仅有约90个是已知药物的靶点,还有近300个包括孤儿受体的成员作为靶点有广阔药物开发空间和重大价值。
由于在信号转导过程中发挥核心作用,GPCR也是药物开发领域的“明星”。癌症、心脏病、糖尿病、阿尔茨海默症等这些危害人类健康的重大疾病都与GPCR密不可分。当前约50%的上市药物作用于GPCR,但是在800多个GPCR成员里仅有约90个是已知药物的靶点,还有近300个包括孤儿受体的成员作为靶点有广阔药物开发空间和重大价值。

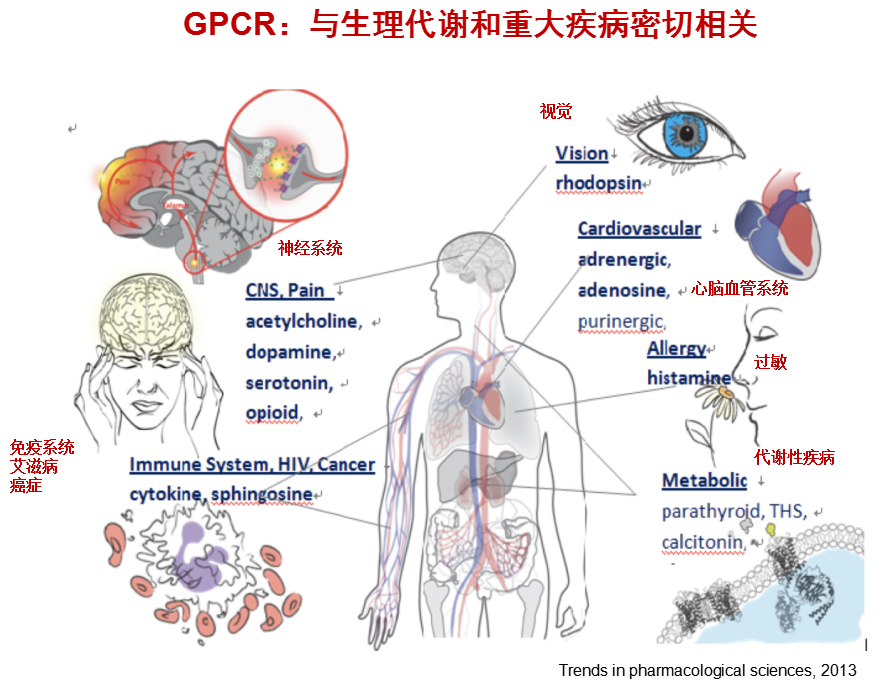
G蛋白偶联受体(GPCR)是真核生物中最大,种类最多的膜受体。G蛋白是能够结合三磷酸鸟苷(GTP)和二磷酸鸟苷(GDP)的特殊蛋白质。与GPCR相关的G蛋白是异源三聚体,这意味着它们具有三个不同的亚基:α亚基,β亚基和γ亚基。这些亚基中的两个α和γ通过脂质锚定物附着在质膜上。配体与GPCR的结合会引起受体构象的改变,进而结合并激活不同亚型的G蛋白。然后,G蛋白的活性形式从受体表面释放出来,解离成其α-和β/γ亚基。然后,两个亚基都将激活其特定的效应子,从而释放第二信使。这些信使被蛋白激酶识别,从而导致其活化并触发朝向细胞事件的信号级联。

第二信使释放酶主要分为两类,均被不同类型的G蛋白激活或灭活。Gαs和Gαi亚型分别激活或灭活腺苷酸环化酶,该酶将三磷酸腺苷(ATP)转换成环状单磷酸腺苷(cAMP),在此过程中释放出无机焦磷酸盐。其他亚型(例如Gαq或Gαo)将激活磷酸肌醇磷脂酶C酶(PLC),该酶将磷脂酰肌醇4,5-双磷酸酯(PIP2)水解为sn-1,2,二酰基甘油(DAG)和肌醇1,4,5-三磷酸(IP3)。IP3与内质网钙通道结合,触发钙离子释放到细胞质中。
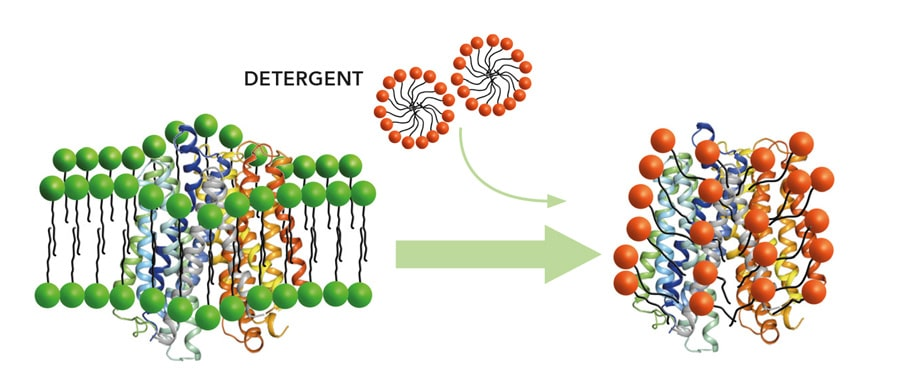
GPCR的分离和纯化是GPCR功能研究和结构研究中的关键步骤
为了溶解得到跨膜蛋白,破坏膜双层结构是必要的。通常使用去垢剂的方法。去垢剂是一种两性分子,同时包含疏水和亲水的部分,并且在水中会形成胶束。胶束是去垢剂亲水头向外,疏水头向内排列的聚集体形式。去垢剂溶解蛋白通过一端结合蛋白的疏水部分,另一端结合亲水部分。去垢剂的选择应该足够溶解膜蛋白而不会造成不可逆的变性。
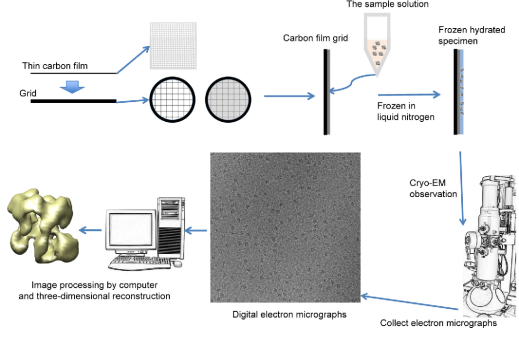
基于结构的药物发现(Structure-based drug discovery,SBDD)是一种基于靶点的原子级结构基础信息,针对该靶点进行理性药物设计的研发方法。SBDD工作的瓶颈在于获取高分辨率的生物靶点结构信息。虽然一些小而有序的生物分子满足X射线晶体学的研究范畴,但大部分已知靶点中的蛋白质,例如跨膜受体或动态复合物,都难以结晶,导致这些靶点蛋白无法利用晶体手段进行高分辨率结构解析。冷冻电镜技术相比X射线晶体学的主要优势在于,它可以跳过繁琐的结晶步骤,从而直接对玻璃化的生物大分子进行成像;冷冻电镜也可以提供更多维度的信息,包括异质性和动态性。
咨询
- 315
- 点赞
- 复制链接
- 举报