干细胞分离、表面标志物流式鉴定及增殖能力和分化能力(成骨诱导,成脂诱导等)检测的整体解决方案
干细胞概述
作为生命的种子,干细胞在生物界叱咤风云已久,是目前公认的明日之星。从“多利”绵羊的诞生,到诱导性多能干细胞(iPSC)的发现。再到现如今,无论是疾病模型,细胞治疗还是器官移植再生医学方面的突飞猛进,都让我们始终相信干细胞治疗的愿景终将实现。
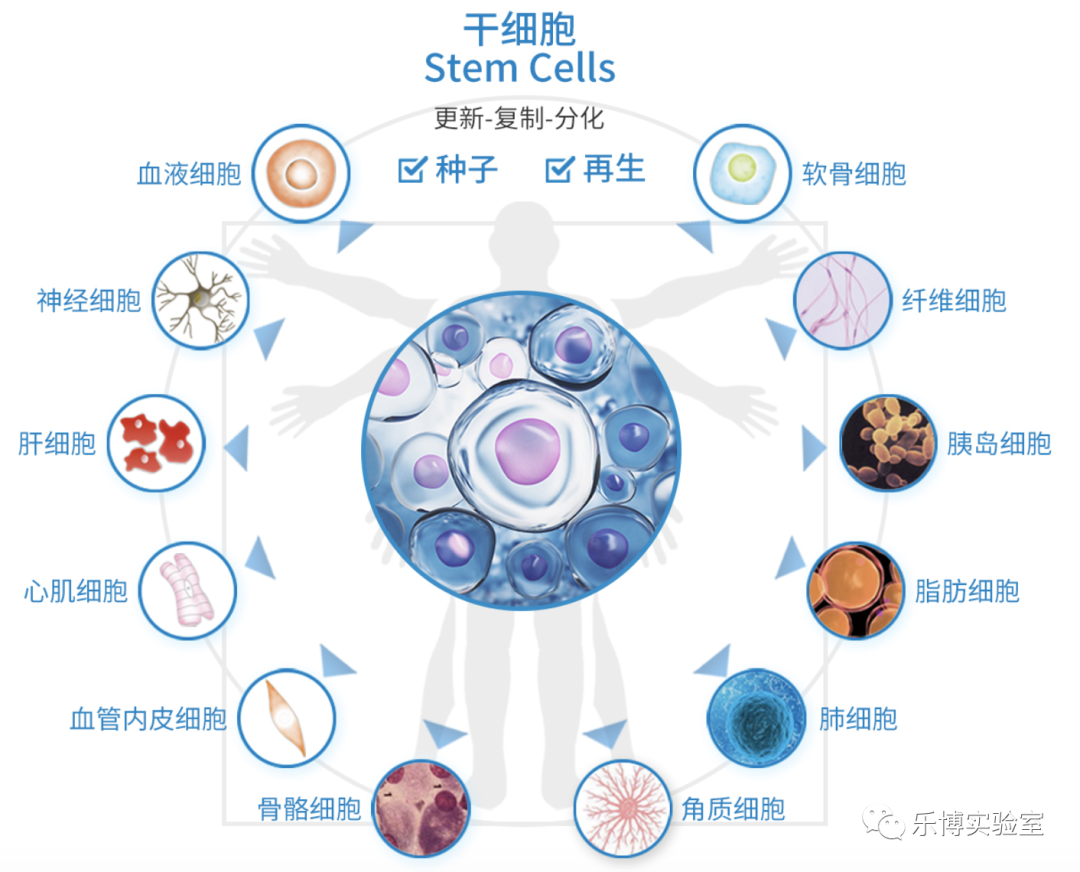
干细胞的鉴定主要从形态学和功能学两方面来进行。形态学方面的鉴定包括表面形态、表面标记分析—流式鉴定(FACS)、免疫组化等。功能学方面的鉴定主要包括增殖能力(自我更新能力)和分化能力(成骨诱导分化,成脂诱导分化,成软骨诱导分化)等鉴定。
“乐博维康”可提供常规各种类型干细胞分离及表面标记鉴定的流式整体解决方案,并能够提供完整的增殖能力,成骨成脂等诱导的分化能力鉴定服务,为您的“干细胞”研究增砖添瓦!
干细胞鉴定步骤
1、准备细胞:取培养的细胞离心(300g/5min)弃去上清,以Buffer溶液重悬,注意观察细胞的分散程度,是否有团块,若有团块,需静置3-5分钟,弃去团块,并再次静置3-5分钟,继续观察细胞分散程度,若仍有团块,则重复上面步骤,加入一定量PBS洗涤一次,弃去上清。
2、弹散细胞,计算需要检测的细胞量,并用细胞计数仪对细胞悬液进行计数,稀释到所需的细胞数,细胞重悬到5*106 ~10*10⁶ /ml之间;
3、取100 μl的细胞于EP管或流式管内,按量加入抗体,加入抗体时必须和细胞保持充分的混合,可在震荡仪上稍微混匀。在4℃冰箱孵育30分钟。
4. 每样品管加入1.5~2ml Buffer溶液,重悬细胞,250g离心4min后弃去上清。
5. 重复洗涤一次,吸去上清液。于每个样品管内各加入100ul Buffer溶液,重悬细胞。
6. 按量于各个样品管内加入相对应的二抗,加入抗体时必须和细胞保持充分的混合,可在震荡仪上混匀(避光)。
7. 室温或4℃避光孵育30min。
8. 于每样品管内添加适量(1.5~2ml)Buffer溶液,用最大量程为1ml的移液枪小心吹打混匀。
9. 离心(244g,4min),吸去上清液。
10. 于每样品管加入400μl Buffer溶液,重悬细胞,用滤网过滤细胞,上机检测。
检测指标
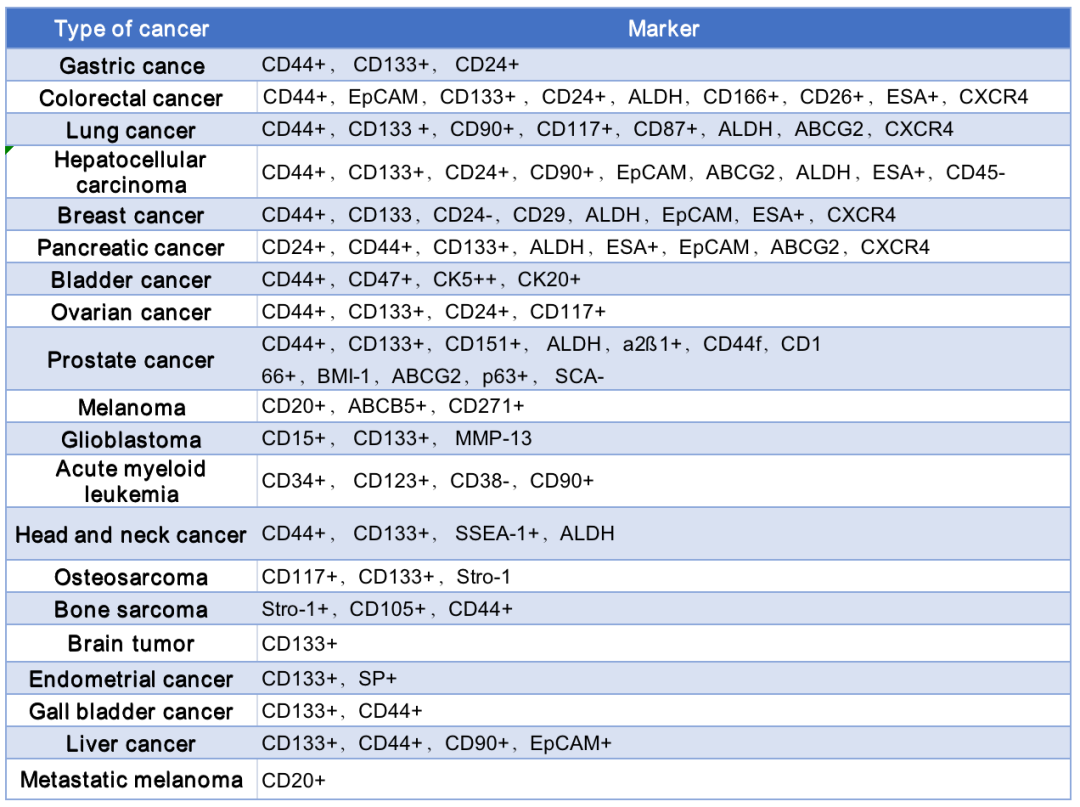
肿瘤干细胞(Cancer Stem Cells, CSCs),也被称为肿瘤启动细胞(tumor initiating cell ,TICs),被认为是肿瘤组织内有自我更新、高致瘤性, 分化潜能等特征的一个小细胞亚群(1%-5%),是维持肿瘤生长的核心,通过与肿瘤微环境相互作用,CSCs可维持自身的可塑性,同时促进肿瘤发生、发展、侵袭、转移等过程。
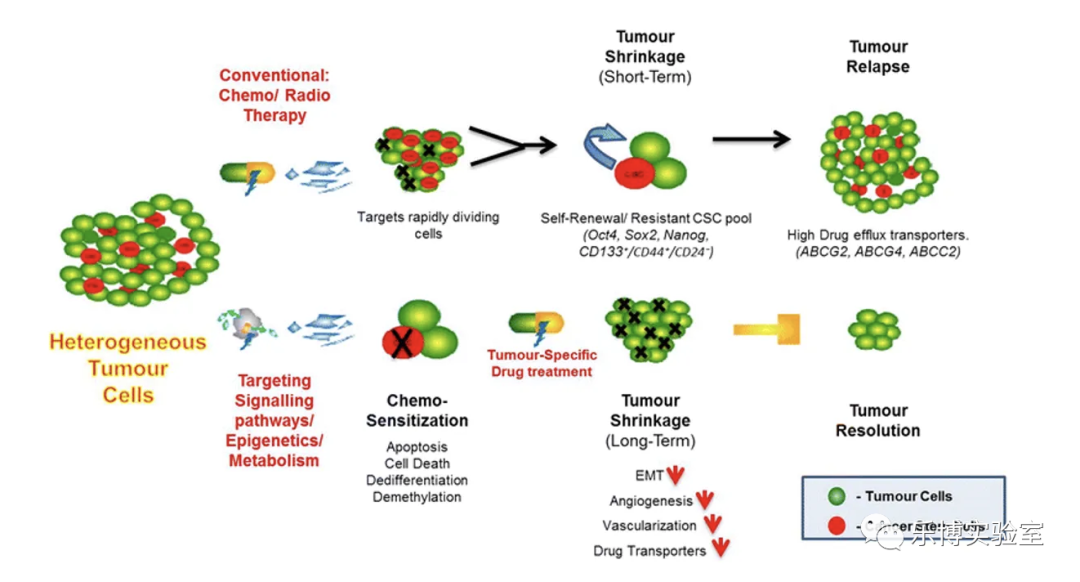
(1)体内致瘤实验,将CSC接种于免疫缺陷动物, 经过一段时间培养, 观察免疫缺陷动物肿瘤生长情况.;其中异体移植实验被认为是鉴定CSC的金标准;
(2)体外克隆实验;普通肿瘤细胞在有限次传代后便会死亡;CSC因其有极强的自我更新及无限增殖功能, 能连续传代;
(3)传代培养,CSC有多向分化能力, 在体外培养时, CSC向普通肿瘤细胞分化, 最终失去分化能力;
(4)ALDH1、Hoechst33342染料法等;
(5)根据表面标志物进行流式鉴定及分选。
受肿瘤环境、分离、培养等条件影响,使用表面标志物进行肿瘤干细胞的鉴定需要考虑诸多因素:
1. 肿瘤标志物的选择:肿瘤发展到不同时期,表面标志物表达水平在不同微环境中, 由于各种生长因子的影响, 或是其他影响因素可致其发生动态变化;而已分选出的CSC在体外培养条件下也可能发生显著的表型变化;
2. 一种类型的CSC标志物不能用于鉴定其他类型的CSC;
3. 有些表面标志物对酶消化敏感,而实体肿瘤的CSCs鉴定及分离必须经过酶消化;可以使用Ca2+螯合的EDTA替代胰酶消化。此外,有文章中作者提到其实验室在清洗步骤时使用了预冷不含Ca2+的PBS作为清洗液,接着使用含有2mM EDTA的PBS孵育并在全培养基中用枪吹打解离,这些尝试对于解离哺乳动物细胞系是比较有效的[9];
4. EDTA长时间孵育会导致细胞聚集,对于不同的细胞系其解离时的孵育时间需要分别优化;

3、人间充质干细胞
间充质干细胞在基础研究和临床细胞治疗领域都有广泛的应用,其组织来源以及分离、培养方法多种多样,为规范化MSC相关研究,国际细胞治疗协会,即ISCT(International Society for Cellular Therapy)规定了人MSCs培养后的鉴定标准:
1、正常培养条件下贴壁生长;

4、神经干细胞(NSCs)
神经干细胞具有分化为神经元、星形胶质细胞、少突胶质细胞的能力,能进行自我更新并分化形成新的脑组织细胞。作为最特殊一种干细胞,NSCs的研究已成为近年来脑科学研究的一个重要方向,也是目前生命科学研究的热点,如何正确鉴定各种神经细胞的表型对于培养过程和后期应用都具有十分重要的意义。
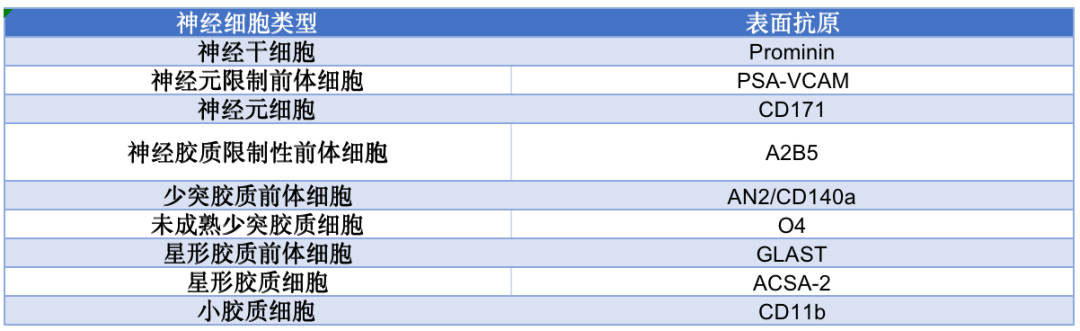
5、造血干细胞/祖细胞
造血干细胞/祖细胞的研究为深入了解造血及造血干细胞在临床治疗中的应用做出了重大贡献。美天旎为您提供用于人HSC/HPC研究的完整解决方案。所有用于人HSC/HPC研究的产品都是经过优化的,可将我们提供的标准方法直接应用于HSC细胞的分离、培养和分析这一完整的实验过程。

6、小鼠骨髓间充质干细胞

7、大鼠骨髓间充质干细胞

8、大鼠脂肪间充质干细胞
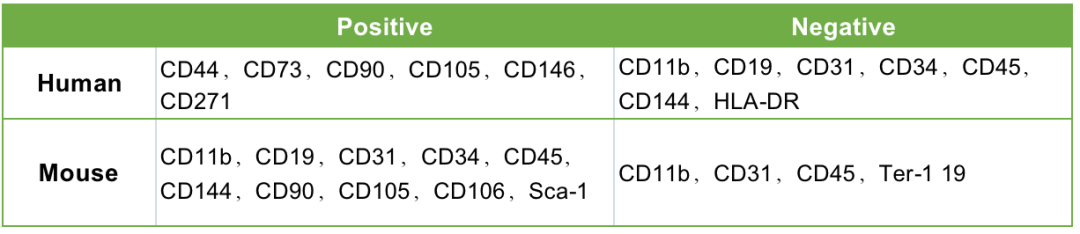
Tips:国际细胞治疗协会间充质和组织干细胞委员会2006年提出了MSC鉴定的最低标准,关于细胞表型的要求是表达CD90,CD105和CD73,不表达CD45,CD34,CD14或CD11b,CD79a或CD19和HLA-DR;阳性指标都需要染色,阴性指标一般选择2-3个指标,因为是做细胞表型鉴定,所以最好要配齐同型对照。
干细胞功能蛋白
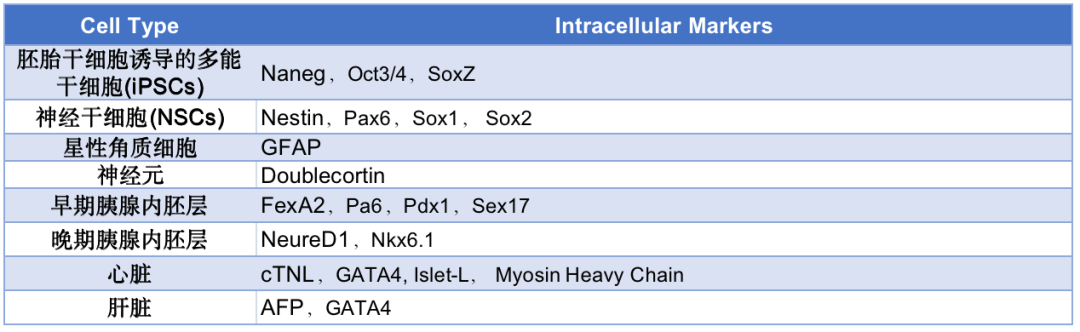
干细胞筛选标志物
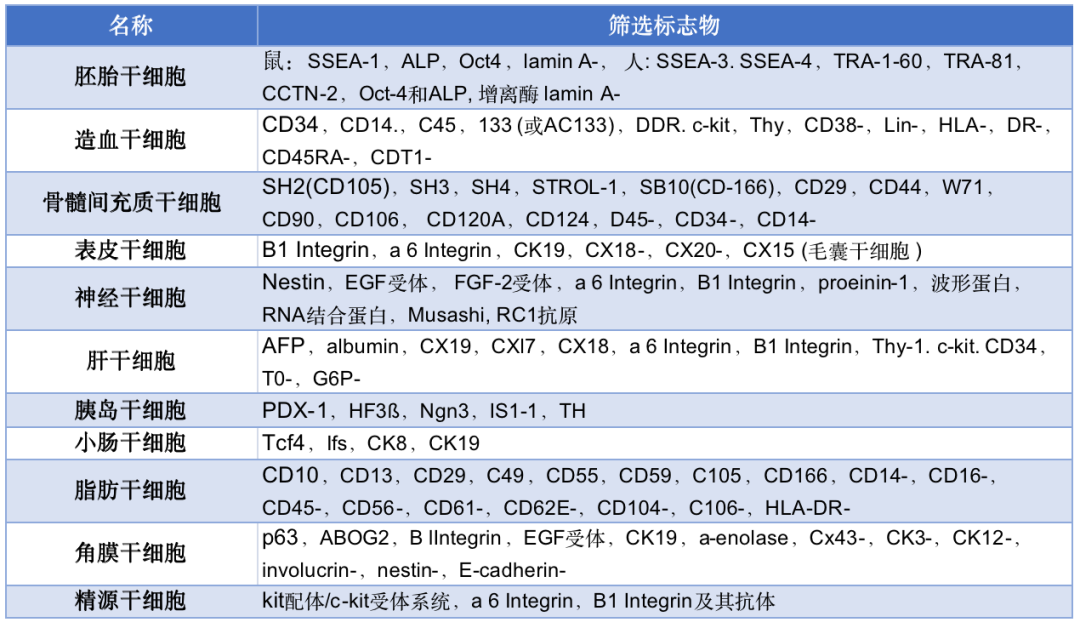
干细胞成脂成骨定向诱导分化
概述
干细胞和祖细胞群体存在于多种成体组织中,包括皮肤、肌肉、骨髓和脂肪。在体外不同条件下诱导分化为骨、软骨及其他结缔组织,因其来源广泛,分离无创伤,较低的免疫原性、生长周期短等特点,是组织工程种子细胞的重要来源。干细胞的诱导分化一方面是干细胞鉴定的主要方法,另一方面也是干细胞功能学研究的主要途径。采用体外条件培养基诱导培养下,人间充质干细胞应能够分化为成脂肪、骨、软骨细胞。成脂分化经油红O染色法鉴定,成骨分化经茜素红染色法鉴定,成软骨分化经阿尔辛蓝染色法鉴定。近年来,人们发现成体脂肪组织可作为间充质干细胞另外一一个丰富的来源。这群细胞被命名为脂肪来源的干细胞(ASCs)。在特定的培养条件下,ASCs可诱导分化为多种间充质和神经类型细。
应用范围
1. 干细胞分化能力鉴定;
2. 肿瘤干细胞干性相关研究;
3. 某类干细胞成脂定向分化机制研究;
4. 某类干细胞成骨定向分化机制研究;
5. 干细胞以及肿瘤干细胞外泌体治疗疗效机制研究;
6. 骨发育相关疾病机制研究;
7. 骨代谢相关疾病机制研究;
8. 骨衰老相关机制研究;
9. 骨损伤相关疾病机制研究;
10. 骨质疏松相关疾病机制研究;
11. 骨肿瘤相关疾病机制研究;
12. 肥胖相关疾病机制研究;
13. 其他脂肪相关疾病机制研究。
成骨诱导分化
1. 使用前,请将血清置于2-8℃环境中过夜解冻直至血清完全溶解,轻晃试剂瓶以确保血清混合均匀。
注意:解冻后的血清中可能会含有少量絮状沉淀,这些物质对产品质量无影响。不建议
采取过滤的方法去除沉淀物,此操作会导致血清中部分营养物质流失。
2. 配制前30 min左右,室温溶解抗坏血酸,β-甘油磷酸钠,双抗和谷氨酰胺,轻轻地上下颠倒试剂管以确保试剂混合均匀。
注意:在打开盖子前先短暂离心(2400 g),以确保添加试剂能全部收集。
3. 使用前10 min,室温溶解地塞米松。
注意:在打开盖子前先短暂离心(2400 g),以确保添加试剂能全部收集。
4. 用70%乙醇擦拭试剂盒中各瓶/管的开口外壁,室温放置数秒使酒精挥发。
5. 在超净台中无菌地打开以上各瓶/管。
6. 将抗坏血酸、β-甘油磷酸钠、成人脂肪间质干细胞专用胎牛血清、双抗和谷氨酰胺全部加入成人脂肪间质干细胞成骨诱导分化基础培养基中。
7. 无菌吸取少量基础培养基洗涤各瓶/管,尽可能的将所有组分完整的加入基础培养基中。
8. 最后将地塞米松加入基础培养基中,吸取0.5 mL基础培养基洗涤试剂管,将混合物一同加入基础培养基中。
9. 重复操作步骤 8。
10. 轻晃配制好的完全培养基,确保混合均匀之后即可使用。
二、培养器皿表面的明胶包被
为了避免诱导过程中间质干细胞出现漂浮现象,建议对成骨诱导使用的培养器皿
表面进行明胶包被。
所需材料
1. 明胶溶液
操作
1. 加适量0.1%明胶到培养器皿中,能覆盖整个培养器皿底面的量即可。
2. 摇匀液体使其覆盖整个培养器皿的底面。
3. 将铺有0.1%明胶的培养器皿放置在超净台至少30min。
4. 30 min后弃去明胶,待培养器皿晾干后,即可用于接种细胞。
注意: 包被明胶的培养器皿在无菌和明胶不蒸干的条件下,可以在4℃保存两周。
三、成骨诱导分化操作规程
所需材料
1. 0.25%Trypsin-0.04%EDTA
2. 生理盐水
3. 成人脂肪间质干细胞完全培养基
4. 成人脂肪间质干细胞成骨诱导分化完全培养基
操作
注意:本操作规程以六孔板为例
1. 将成人脂肪间质干细胞置于37℃,5% CO2的培养箱中培养。
2. 当细胞融合度达到80-90%时,用0.25%Trypsin-0.04%EDTA进行消化。
3. 将先包被0.1%明胶的六孔板中的多余明胶吸去,并用生理盐水清洗1-2次。
4. 将消化下来的成人脂肪间质干细胞按照2×104cells/cm2 的细胞密度接种在事先包被0.1%明胶的六孔板中,每孔加入2 mL完全培养基。。
5. 将细胞置于37℃,5% CO2的培养箱中进行培养。
6. 当细胞融合度达到80%-90%时,小心的将孔内完全培养基吸走,向六孔板中加入2 mL/well 成人脂肪间质干细胞成骨诱导分化完全培养基。
7. 每隔3天换用新鲜的成人脂肪间质干细胞成骨诱导分化完全培养基(使用
前需预热至37℃)
8. 诱导2-4周后,肉眼观察可发现大量白色物质析出,镜下观察可发现细胞抱团成红褐色梭状,即可用茜素红进行染色。
注意:为防止成骨细胞脱落,建议成骨过程中出现大量钙结节之后,换液形式变为每两天一次半量换液。
四、茜素红染色分析
所需材料
1. 生理盐水
2. 4%中性甲quan溶液
3. 茜素红染液
操作
1. 成骨诱导分化结束后,吸走六孔板中的成骨诱导分化完全培养基,用生理盐水冲洗1-2次。每孔加入2 mL 4%中性甲quan溶液,固定30 min。
2. 吸走中性甲quan溶液,用生理盐水冲洗1-2次。每孔中加入1mL茜素红染液染5-10min。(茜素红平常呈黄色,与钙快速反应,溶液颜色快速变为红色,即可初步判定为实验诱导成功)
3. 吸走茜素红染液,用生理盐水冲洗2-3次。
4. 将培养板置于显微镜下观察成骨染色效果。
下图为成人脂肪间质干细胞成骨诱导分化茜素红染色效果

ADSCs成骨对照

4X

10X

20X

40X
1. 所有产品均需避光保存。
2. 间质干细胞成骨诱导分化基础培养基和茜素红置于2-8℃保存,保质期为1年;其他成分置于-20℃保存,保质期为2年;完全培养基配制好后于2-8℃保存,保质期为1个月。
3. 所有产品请于保质期内使用,超过保质期,必须放弃使用。
4. 为确保产品质量,请避免反复冻融相关产品。
1. 使用前,请将血清置于2-8℃环境中过夜解冻直至血清完全溶解,轻晃试剂瓶以确保血清混合均匀。
注意:解冻后的血清中可能会含有少量絮状沉淀,这些物质对产品质量无影响。不建议
采取过滤的方法去除沉淀物,此操作会导致血清中部分营养物质流失。
2. 配制前30 min左右,室温溶解地塞米松、胰岛素、IBMX、罗格列酮、双抗和谷氨酰胺,轻轻地上下颠倒试剂管以确保试剂混合均匀。
注意:在打开盖子前先短暂离心(2400 g),以确保添加试剂能全部收集。
注意:为了确保溶解效果良好,请将 IBMX 放置于 37℃水浴锅中温热直至完全溶解。
3. 用70%乙醇擦拭试剂盒中各瓶/管的开口外壁,室温放置数秒使酒精挥发。
4. 超净工作台中将成人脂肪间质干细胞专用胎牛血清、双抗和谷氨酰胺全部加入成人脂肪间质干细胞成脂诱导分化培养基 A 液基础培养基中。
5. 无菌吸取少量A液基础培养基洗涤各瓶/管,尽可能的将所有组分完整的加入A液基础培养基中。
6. 将地塞米松、胰岛素、IBMX和罗格列酮全部加入A 液基础培养基中。
7. 无菌吸取少量A液基础培养基洗涤各瓶/管,尽可能的将所有组分完整的加入A液基础培养基中。
8. 重复操作步骤7。
9. 轻晃配制好的完全培养基,确保混合均匀之后即可使用。
二、成脂诱导分化培养基 B液的配制
1. 使用前,请将血清置于2-8℃环境中过夜解冻直至血清完全溶解,轻晃试剂瓶以确保血清混合均匀。本公司血清经热灭活处理,解冻后即可使用。
2. 配制前30 min左右,室温溶解胰岛素、双抗和谷氨酰胺,轻轻地上下颠倒试剂管,以确保试剂混合均匀。
注意:在打开盖子前先短暂离心(5000 g),以确保添加试剂能全部收集。
3. 用70%乙醇擦拭试剂盒中各瓶/管的开口外壁,室温放置数秒使酒精挥发。
4. 超净工作台中将成人脂肪间质干细胞专用胎牛血清、双抗和谷氨酰胺全部加入间质干细胞成脂诱导分化培养基 B 液基础培养基中。
5. 无菌吸取少量 B 液基础培养基洗涤各瓶/管,尽可能的将所有组分完整的加入B液基础培养基中。
6. 将胰岛素加入B 液基础培养基中。
7. 无菌吸取少量 B 液基础培养基洗涤试剂管,尽可能的将所有组分完整的加入 B 液基础培养基中。
8. 重复操作步骤7。
9. 轻晃配制好的完全培养基,确保混合均匀之后即可使用。
三、成脂诱导分化操作规程
所需材料
1. 0.25%Trypsin-0.04%EDTA
2. 生理盐水
3. 成人脂肪间质干细胞完全培养基
4. 成人脂肪间质干细胞成脂诱导分化完全培养基
操作
注意:本操作规程以六孔板为例
1. 将成人脂肪间质干细胞37℃,5% CO2的培养箱中培养。
2. 当细胞融合度达到80%-90%时,用0.25%Trypsin-0.04%EDTA进行消化。
3. 将消化下来的间质干细胞按照2×104 cells/cm2的细胞密度接种在六孔板中,每孔加入2 mL完全培养基。
4. 将细胞置于37℃,5% CO2的培养箱中进行培养。
5. 每隔三天换液,直到细胞融合度达到100%或者过融合。
6. 小心地将间质干细胞完全培养基吸走,向六孔板中加入2 mL成人脂肪间质
干细胞成脂诱导分化培养基 A 液。
7. 诱导3天后,吸走六孔板中的A液,加入2 mL成人脂肪间质干细胞成脂诱导分化培养基B液。
8. 24h后,吸走B液,换回A液进行诱导。
9. A液和B液交替作用3-5次后(12-20天),继续用 B 液维持培养4-7天直到脂滴变得足够大、圆。B 液维持培养期间,每隔2-3天需要换用新鲜的B液。
10.肉眼观察可发现大量白色物质析出,镜下观察可发现细胞抱团成红褐色梭状,即可用油红O进行染色。
四、油红 O 染色分析
所需材料
1. 生理盐水
2. 蒸馏水
3. 4%中性甲quan溶液
3. 油红O染液
操作
1. 成脂诱导分化结束后,吸走六孔板中的间质干细胞成脂诱导分化培养基,用
生理盐水冲洗1-2次。每孔加入2 mL 4%中性甲quan溶液,固定30 min。
2. 吸走中性甲quan溶液,用生理盐水冲洗1-2次。每孔中加入1 mL油红O染料工作液染色30min(工作液配制方法:油红O贮存液:蒸馏水=3:2,混匀后用中性滤纸过滤即可,现用现配)。
3. 吸走油红O染液,用生理盐水冲洗2-3次。
4. 将培养板置于显微镜下观察成脂染色效果。
下图为成人脂肪间质干细胞成脂诱导分化油红O染色效果
ADSCs成脂对照
4X
10X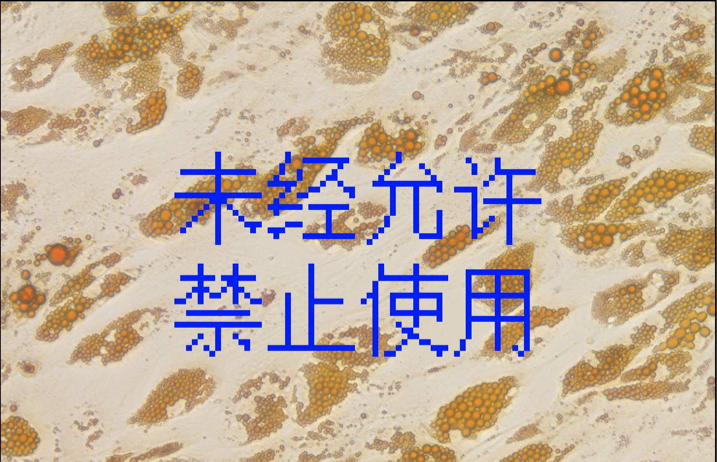
20X
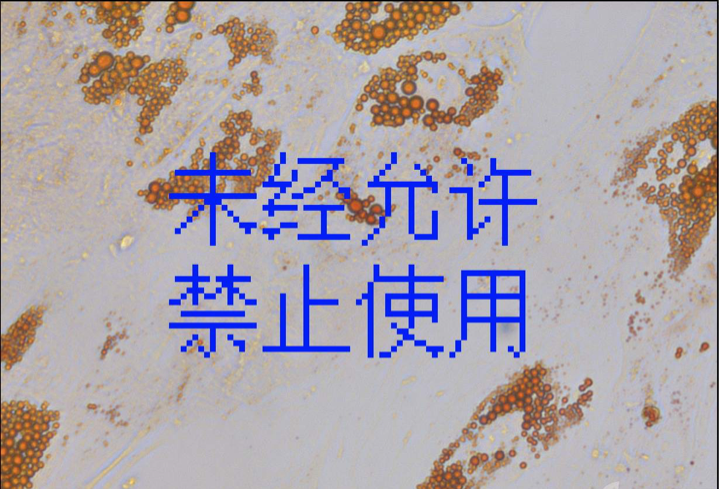
40X
五、产品稳定性及保存条件
1. 所有产品均需避光保存。
2. 间质干细胞成脂诱导分化 A 液和 B 液的基础培养基和油红O置于2-8℃保存,保质期为1年;其他成分置于-20℃保存,保质期为2年;完全培养基配制好后于2- 8℃中保存,保质期为1个月。
3. 所有产品请于保质期内使用,超过保质期,必须放弃使用。
4. 为确保产品质量,请避免反复冻融相关产品。
咨询
- 538
- 点赞
- 复制链接
- 举报





