人胰岛和肝脏类器官在芯片上的功能串联共培养:一种新的人2型糖尿病体外模型
我们迫切需要研究疾病和药物治疗效果的人体体外生理模型作为更相关的工具,以确定新的药物靶点和治疗方法。我们开发了一种基于胰岛素和葡萄糖调节的人胰岛-肝脏串联共培养的微流控双器官芯片模型。我们已经建立了一种有力的人胰岛和肝脏类器官串联共培养的方法,在无胰岛素的培养基中维持功能长达15天。在不同的葡萄糖耐受实验中,胰岛在葡萄糖负荷下释放胰岛素,证实了功能串联促进了肝脏对葡萄糖的吸收。串联培养维持餐后循环
人胰岛和肝脏类器官在芯片上的功能串联共培养:一种新的人2型糖尿病体外模型
Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model
Sophie Bauer1, Charlotte Wennberg Huldt2, Kajsa P. Kanebratt3, Isabell Durieux1, Daniela Gunne1, Shalini Andersson 3, Lorna Ewart4, William G. Haynes2, Ilka Maschmeyer1, Annika Winter1, Carina Ämmälä2, Uwe Marx1 & Tommy B. Andersson3,5
1TissUse GmbH, Berlin, Germany.
2Bioscience Diabetes, Cardiovascular and Metabolic Diseases, IMED Biotech Unit, AstraZeneca, Gothenburg, Sweden.
3DMPK, Cardiovascular and Metabolic Diseases, IMED Biotech Unit, AstraZeneca, Gothenburg, Sweden.
4Drug Safety and Metabolism, IMED Biotech Unit, AstraZeneca, Cambridge, UK.
5Department of Physiology and Pharmacology, Section of Pharmacogenetics, Karolinska Institutet, Stockholm, Sweden.
翻译整理:北京佰司特贸易有限责任公司
背景介绍
我们迫切需要研究疾病和药物治疗效果的人体体外生理模型作为更相关的工具,以确定新的药物靶点和治疗方法。我们开发了一种基于胰岛素和葡萄糖调节的人胰岛-肝脏串联共培养的微流控双器官芯片模型。我们已经建立了一种有力的人胰岛和肝脏类器官串联共培养的方法,在无胰岛素的培养基中维持功能长达15天。在不同的葡萄糖耐受实验中,胰岛在葡萄糖负荷下释放胰岛素,证实了功能串联促进了肝脏对葡萄糖的吸收。串联培养维持餐后循环中的葡萄糖浓度,而两种单独培养的类器官中葡萄糖水平保持偏高。因此,分泌到循环中的胰岛素刺激了肝脏类器官对葡萄糖的摄取,而后者,在没有胰岛素的情况下,并没有有效地消耗葡萄糖。随着葡萄糖浓度的降低,胰岛素分泌减少,表明肝脏和分泌胰岛素的胰岛之间存在一个功能反馈回路。最后,实验室间验证了稳定性和重现性。该模型的进一步发展,使用诱导糖调节受损的工具,应该提供一个独特的体外系统模拟人类2型糖尿病。
研究介绍
微流体微生理系统中的人体长期类器官培养(MPS;或器官芯片)可以模拟人体生物学,因此,可以对器官的生理功能、器官间的交流和药物的药理作用进行详细的时间研究。多磺酸粘多糖工作的一个主要目标是概述疾病状况和研究药物治疗的效果。这样的模型有潜力改变药物发现,使有效的研究和潜在的识别,新的药物靶标,以及测试药物干预在生理相关模型。最近的一些文章报道在相关人体器官模型的开发方面取得了相当大的进展,如人体单器官芯片模型:lung-on-a-chip或liver-on-a-chip平台。进一步发展中的肺和肝脏的培养物。
然而,系统性的人类疾病的发展都是通过破坏两个或多个器官的自我平衡和相互交流。为了模拟这种系统的相互作用,一些微生理平台正致力于在不同的培养小室中开发不同类器官在芯片上的串联共培养,通过微流控通道相互连接。在多器官芯片(MOC)平台上,首次成功地建立了人体皮肤活检组织与3D人肝脏类器官体的有机稳态长期串联共培养。随后,以MOC为基础的肝脏类器官形体与人3D肠类器官长期串联共培养和神经建立组织模型进行系统重复剂量药物试验。
2型糖尿病(T2DM)的发病率正在上升,并与多器官合并症有关。由于胰岛素抵抗,胰岛通过增加分泌和扩大胰岛体积来满足不断增加的胰岛素需求。只有当胰岛无法适应时,血糖水平才会升高,并出现明显的2型糖尿病。由于胰岛素是肝脏代谢的关键调节因子,将葡萄糖的平衡从产生葡萄糖转变为储存葡萄糖,因此肝脏胰岛素抵抗可导致糖稳态受损,从而定义2型糖尿病。过去已经产生了多种表现T2DM不同特征的动物模型。尽管如此,从动物研究中进行的外推导致了从分子机制发现到表型表现和疾病进展再到新疗法的药理作用的研究转化不佳,无法理解和改善葡萄糖代谢。重要的是,目前临床使用的许多抗糖尿病药物,虽然能有效地治疗症状,但对疾病进展的影响有限。胰腺和肝脏是参与维持葡萄糖稳态的两个关键器官,其微生理串联共培养系统可以为模拟T2DM提供一个独特的平台。因此,我们的目标是建立一个人体双器官芯片(2-OC)模型,复制胰岛和肝脏类器官之间的长期生理交流。
朗格汉斯胰岛是分布在胰腺外分泌部分的内分泌细胞器。它们由至少五种不同的细胞类型组成:α细胞(分泌胰高血糖素),β细胞(胰岛素),γ/ PP细胞(胰腺多肽),δ细胞(生长抑素)和ε细胞(胃饥饿素)。孤立的胰岛为研究胰岛功能和激素分泌提供了一个有用的模型。到目前为止,MPS仅用于胰岛的短期培养,以评估激素分泌情况以及与内皮细胞的相互作用。本研究中使用的3D InSight™胰岛(InSphero AG,瑞士)是由重组的分散的人类胰岛细胞产生的,保留了代表正常人类胰岛的α, β和δ细胞的组成。在长达四周的长期培养中,3D胰岛对葡萄糖负荷保持正常的胰岛素分泌反应。
在肝脏中,胰岛素刺激糖原合成并抑制糖原分解。它还能刺激糖酵解和抑制糖异生。胰岛素除了对葡萄糖代谢有影响外,在肝脏中还有多种合成代谢作用,促进脂质合成和释放,蛋白质合成,抑制这些物质的分解。一些研究已经探索了建立人体肝脏器官模型的各种平台。该领域的主要工作是利用人类原代肝细胞或肝癌细胞系进行药物代谢和毒性研究。在本研究中,我们使用的是由肝癌细胞(HepaRG细胞)形成的球形细胞,这是一种类似人类原代肝细胞特征的癌细胞,已经成功地用于药物代谢和毒性研究。肝细胞在脂质肪或者药物诱导脂肪肝的研究中是有用的,表明它们作为代谢性疾病模型的价值。在静态培养长达21天的培养期内,HepaRG细胞形成三维球体在,其功能性能得到了改善。此外,包括产生细胞外基质的星状细胞对HepaRG肝脏类器官体的形成和长期保存至关重要。
我们将人肝脏类器体(HepaRG细胞和原代人肝星状HHSteC细胞)与人胰岛类器体串联共培养,模拟其生理水平的交流。尤其是,我们想要建立由胰岛素的生物来源——胰岛驱动的循环葡萄糖的生理调节。
反过来,我们打算研究葡萄糖对胰岛素分泌的影响。实验在两个独立的实验室进行,以建立实验室间的重现性。后者是进一步发展为可靠的人类T2DM模型的基础。
双器官芯片串联共培养的设计
使用2-OC培养基培养人胰岛和肝脏类器官(图1A和B)。培养小室和相互连接的微流控通道共含有610µl的培养基。芯片上的微流泵可连续泵液的频率为0.475 Hz、压力为500 mbar的脉动流,平均流量为4.94µl/min,完整的培养基循环周期约为2 h,支持脉动流下的高组织灌流比率。胰岛和肝脏类器官使用常规肝球体的培养基,不添加常规的胰岛素。10个胰岛被放置在含有40个肝球体的腔室上游的腔室中(图1C)。这相当于正常人类胰腺(估计包含大约100万个胰岛)的10万倍。肝脏类器官的肝球体的数量与正常人类肝脏的比例相似。 在两个独立的实验室开发并使用了一个15天的稳定串联共培养过程。这包括组织接种,7次完整的培养基更换和终点组织取样,以进一步分析评估类器官串联培养的长期重现性(图1D)。通过模拟在人体中进行的标准葡萄糖耐量试验(GTT),将培养基中的葡萄糖水平提高到11mm,作为类器官串联培养的一种测量手段,对葡萄糖利用进行了评估。随后,在连续的时间点采集样本(图1D),测量循环培养基中的葡萄糖和胰岛素。
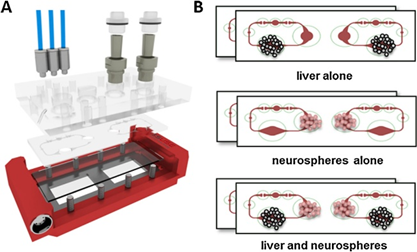
图1:微生理的双器官串联培养芯片(2-OC)。(A)装配设备的3D视图,包括温度支持(红色)。(B)下面的图片,用红色突出显示的是介质电路、各自的培养小室和微型泵阀门。(C) 2-OC串联共培养器官培养物加载标准方案。(D) 15天串联共培养示意图:重复总培养基交换(双箭头,每个室300µl),在0、8、24和48小时额外采样进行葡萄糖耐受试验(灰色箭头,每个室15µl)。
芯片培养前人胰岛和人肝脏类器官的特征
在代表性的类器官培养物转移到2-OC之前,对其功能和形态进行评估。免疫组化证实胰岛中存在产生胰岛素的β细胞和产生胰高血糖素的α细胞(图2A)。此外,所有胰岛(n = 3个供体)在使用前都被证实能根据葡萄糖分泌胰岛素(图2B)。在肝脏类器官中,表达波形蛋白的星形细胞均匀分布在表达细胞角蛋白8-18的肝细胞中(图2C)。此外,通过白蛋白和CYP3A4染色证实了特征性肝细胞标志物的表达(图2E)。与人类原代肝细胞相比,胰岛素受体在肝脏类器官中表达约70%(图2D)。星形细胞中未检测到该表达,而HepaRG细胞是该表达的唯一来源。最后,通过测量Akt磷酸化作为胰岛素受体信号通路的标志来评估肝脏类器官的功能(图2F)。在单层培养的hepg细胞或星形细胞中,胰岛素刺激细胞(白色柱图)和未刺激细胞(黑丝柱图)Akt磷酸化水平均无显著差异。相比之下,球形培养显示胰岛素依赖的Akt磷酸化。有趣的是,这是因为与单层培养相比,基础Akt活性显著降低(0.04±0.02 vs 0.21±0.01 pAkt473/totalAkt)。
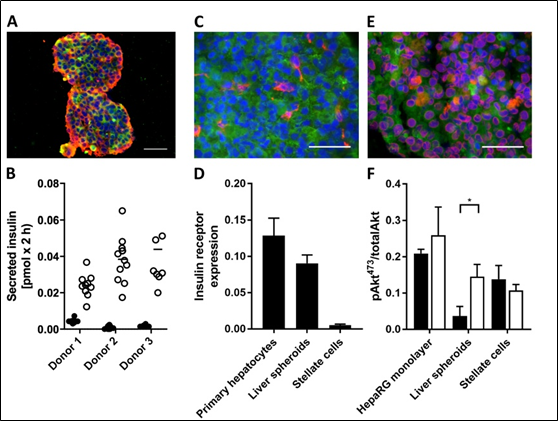
图2。胰岛和肝脏类器官体在串联共培养前的状态。(A)胰岛中胰岛素(红色)和胰高血糖素(绿色)的蛋白表达。细胞核DAPI染色(蓝色)。比例尺:50µm。(B)低糖(2.8 mM,黑点)和高糖(16.8 mM,白点)的单个胰岛葡萄糖刺激胰岛素分泌(GSIS)。(C)肝脏类器官体中细胞角蛋白8/18(绿色)和波形蛋白(红色)的蛋白表达。细胞核DAPI染色(蓝色)。比例尺:50µm。(D)胰岛素受体mRNA在人原代肝细胞、肝脏类器官形细胞和星状细胞中的表达,归一化TATA- box-binding protein, n = 4肝脏类器官形细胞和星状细胞,n = 2人原代肝细胞。数据为平均值±SD。(E)肝脏类器官体中白蛋白(绿色)和CYP3A4(红色)的蛋白表达。细胞核DAPI染色(蓝色)。比例尺:50µm。(F)在未刺激(黑色条)和胰岛素刺激(1nm,白色条)条件下,磷酸化的Akt (pAkt,丝氨酸-473)标准化为总Akt。采用不成对unpaired two-tailed Student t test检验,p < 0.05。数据为mean + SD, n = 3。
胰岛单独培养和串联共培养的长期功能。
在初步测定胰岛和肝脏类器官形组织的结构和功能后,建立串联共培养(胰岛+肝脏)和单独培养(仅胰岛或肝脏),并在2-OC的普通培养基中保持15天。在整个15天的培养期间,串联共培养(图3A)显示出稳定、可重复的循环胰岛素水平(4.3±1.1 nM)。胰岛单培养物中胰岛素水平不稳定,随时间从第3天(11.08±0.81 nM)到第15天(5.66±0.74 nM),降低了49%。在15天的培养期之后,将胰岛从2-OC中移除,并测量GSIS(图3B)。胰岛与肝脏类器官串联共培养,胰岛可长期维持葡萄糖刺激胰岛素分泌,而单独培养的胰岛与第0天相比,胰岛素分泌刺激显著减少。最后,胰岛形态在2-OC培养中没有受到影响,β和α细胞仍然存在,与第0天相比,其相对分布没有明显差异(图2C)。
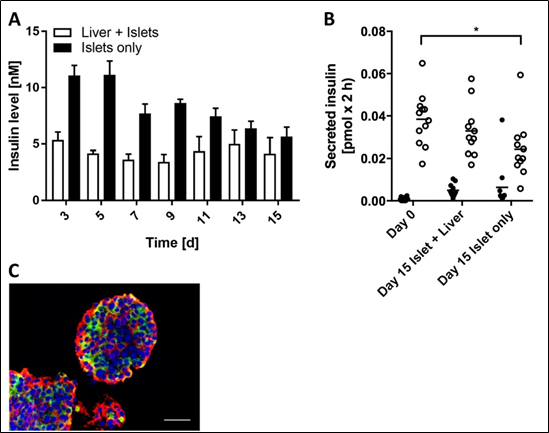
图3:胰岛与肝脏类器官串联共培养15天以上仍能保持功能。(A)在串联共培养和单独胰岛培养基中测定48h后胰岛素积累量。数据为mean + SD, n = 5。(B) 11个胰岛在低(2.8 mM,黑点)和高(16.8 mM,白点)葡萄糖水平下的GSIS。*p < 0.05使用Tukey的多重比较事后检验的方差分析。(C)串联共培养第15天胰岛中胰岛素(红色)和胰高血糖素(绿色)的蛋白表达。细胞核DAPI染色(蓝色)。比例尺:50µm。
肝脏类器官在单独培养和串联共培养中的长期功能。
胰岛分泌的胰岛素促进了肝脏类器官对葡萄糖的利用,显示了串联共培养中组织间的功能性交流。在单独培养中,肝脏类器官在2-OC环境下的15天内,循环葡萄糖浓度稳定维持在接近11 mM(培养基中的浓度)(图4A,黑色柱图)。在培养胰岛(白色柱图),另一方面,循环葡萄糖水平降低48 h内浓度相当于正常餐后水平的人(例如5.9±0.6毫米3天),表明胰岛发布的胰岛素刺激葡萄糖摄取的肝脏。然而,肝脏类器官利用葡萄糖的能力培养的下降随着时间的推移,相对于第3天,但保持稳定从5到15天的8.3±0.87mM。测量微流体培养基中的白蛋白水平,来研究减少葡萄糖利用率是否由于肝脏类器官功能受损。在串联共培养中,白蛋白稳定地产生(在48小时内为9.5±1.5 ng),且与葡萄糖消耗减少无关。此外,组织学不明显,第15天的组织形态完整(图4C)。星状细胞和HepaRG的比值与第0天相比没有变化(图4D),白蛋白和CYP3A4的表达也没有变化(图4E)。
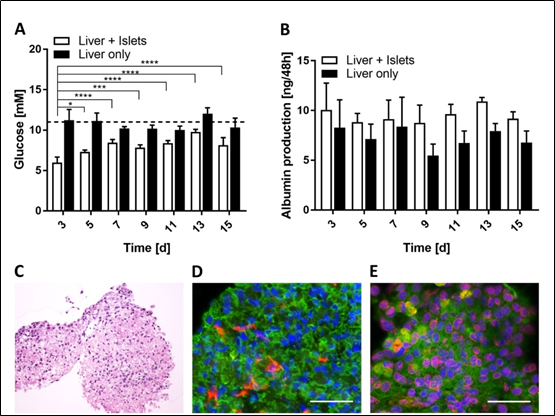
图4。肝脏类器官的长期功能。(A)与单独肝脏类器官相比,串联共培养培养基交换48小时后的葡萄糖水平。虚线表示所施培养基的葡萄糖浓度。*p < 0.05, ***p < 0.001, ****p < 0.0001使用Dunnett多重比较事后检验的方差分析。数据为mean + SD, n = 5。(B)串联共培养(白色柱图)和单培养(黑色柱图)48h以上产生的白蛋白量。数据为mean + SD, n = 5。(C)肝脏类器官经苏木精和伊红串联共培养15天后染色。(D)串联共培养15天后肝脏类器官体中细胞角蛋白8/18(绿色)和波形蛋白(红色)的蛋白表达。(E)串联共培养15d后肝脏类器官体中白蛋白(绿色)和CYP3A4(红色)的蛋白表达。细胞核DAPI染色(蓝色)。比例尺:50µm。
胰岛与肝脏类器官之间的串联共培养。
在培养的第1天、第7天和第13天对高葡萄糖负荷的反应进行了更详细的研究,以研究胰岛素分泌对葡萄糖利用的影响。通过完全培养基更换,将葡萄糖水平提高到11mm。0 h和8、24、48 h取样,总培养基的量减少不超过10%。与单独培养培养相比,在葡萄糖耐量试验(GTT)第一天的24小时内,串联共培养的血糖水平从高血糖降至更正常的血糖范围(3.9 - 7.8 mM)。随后,血糖水平在生理范围内保持平衡,不降至低血糖状态。在没有胰岛素刺激的葡萄糖摄取的情况下,单个培养物(仅胰岛和肝脏)中的葡萄糖水平保持在高血糖范围内(图5A)。通过计算葡萄糖反应曲线下的面积(图5B)来估计串联共培养和单培养之间的葡萄糖利用差异,在串联串联共培养中,葡萄糖反应曲线下的面积显著减少。 在高血糖期间,循环培养基中的胰岛素水平在串联共培养中稳步上升,并在血糖水平下降到正常血糖水平时达到稳定状态(图5C)。胰岛单独培养与串联共培养相比,48h后胰岛素分泌(AUC)显著增加(图5D)。第1天观察到的胰岛-肝脏交流,在两个独立实验室进行的胰岛实验中具有高度重复性。
在整个培养期间,胰岛和肝脏的相互交流保持不变,在第7天和第13天,葡萄糖利用和胰岛素分泌的趋势相似。然而,第1天,葡萄糖浓度达到正常血糖范围较晚,在葡萄糖负荷后24 - 48小时。单独培养在任何的时间点,从来没有达到正常血糖范围(图5 a,E和I)。串联共培养相对单独培养,葡萄糖响应曲线下的面积,在所有时间点相比显著降低(图5 f和J)。串联共培养的胰岛素浓度曲线也与第1天相似,在0 - 24 h之间呈上升趋势,在24 - 48 h之间呈稳定状态(图5G和K)。胰岛单独培养在高血糖状态下维持胰岛素分泌的能力随着时间的推移而降低,在第13天,串联共培养与单独培养,胰岛素反应曲线下面积无显著差异(图5L)。
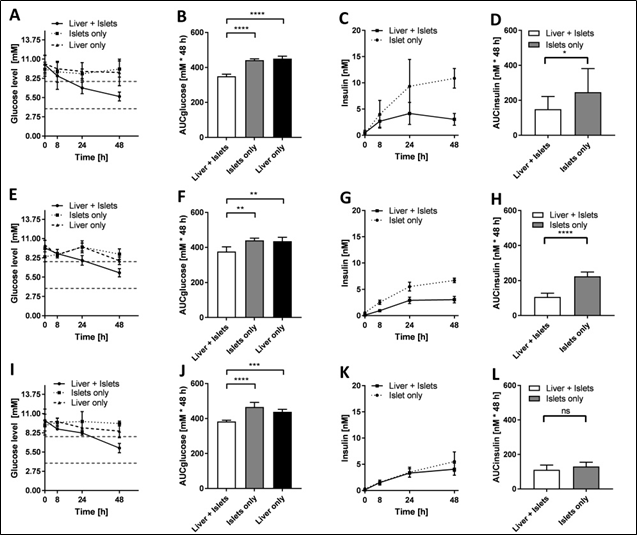
图5。肝脏类器官和胰岛之间的功能性交流。体外GTT第1天(A)、第7天(E)和第13天(I)时的葡萄糖水平。虚线表示生理餐后血糖范围(3.9-7.8 mM)。葡萄糖响应曲线下的面积为1 (B), 7 (F)和13 (J)。在体外胰岛素水平GTT发起的第一天(C), 7 (G)和13 (K)。胰岛素反应曲线下的面积第一天(D), 7 (H)和13 (L)。* * * p < 0.05, p < 0.01, * * * p < 0.001, * * * * p < 0.0001使用方差分析与图基的事后多重比较测试。数据显示为平均值+ SD,数据采集自n = 14,来自三个独立的实验,三个胰岛供体分别在两个不同的实验室在第一通道进行实验,n = 5,来自一个胰岛供体在第二和第三通道进行实验。
研究总结
T2DM是一种多器官疾病。疾病表型和对治疗效果的反应依赖于具有完全代谢功能的器官和它们之间的相关相互作用。在这里,我们提出了一个胰岛和肝脏类器官之间的类器官串联培养交流模型,这是参与葡萄糖体内平衡的两个关键器官。
我们使用了3D类器官,这是相应人体器官的最小的全功能构建块,通过基因编码可以在适当的环境中自我组装。胰岛和小叶分别是人类胰腺(内分泌部分)和肝脏的功能单位。胰岛和肝脏之间的相互作用是正常调节血糖水平的重要机制。当胰岛受到葡萄糖刺激时,胰岛分泌激素流入肝门静脉系统,胰高血糖素和胰岛素影响肝脏,使其将葡萄糖作为糖原储存为燃料,或产生和释放葡萄糖作为能量来源支持外周器官。我们在此培养了10个人肝小叶相匹配的肝脏类器官和10个胰岛,相当于MPS中的100万个胰岛。因此,人类相应的器官——胰腺和肝脏的内分泌部分——缩小了10万倍。这种异速缩放将支持体外到体内的定量转移,用于基于生理学的建模和药理学动力学研究。 本研究在标准化的无胰岛素细胞培养液中建立了一种新型的、稳健的基于微流控芯片的人胰岛和肝脏类器官串联共培养,可再生器官相互干扰持续15天。我们建立了模拟标准静脉注射GTT的胰岛-肝脏串联共培养替代功能GTT;同时评估人体胰岛素分泌和葡萄糖消除的金标准方法。肝脏和胰岛的功能耦合是通过测量胰岛在葡萄糖负荷下释放的培养基中累积的胰岛素来评估的。胰岛素增加了肝脏球状体对葡萄糖的摄取,加速了葡萄糖从培养基中消失的速度。
在串联共培养中,葡萄糖总是恢复到正常的空腹水平,但在单独器官培养中却没有(图3A,E和I)。因此,分泌到循环中的胰岛素刺激了肝脏对葡萄糖的吸收,而单独的肝脏对葡萄糖的消耗并没有那么有效。随着葡萄糖水平的下降,培养基中胰岛素的积累减少,到48小时,葡萄糖和胰岛素都达到了稳定的水平,支持了胰岛和肝脏类器官之间的稳态反馈回路。长期暴露于高糖环境下,缺乏肝脏类器官的胰岛释放胰岛素的能力降低,提示长期高血糖损害胰岛功能。因此,这一结果表明,2-OC下的葡萄糖调节反映了人类葡萄糖稳态,只有在串联共培养条件下才能维持足够的胰岛素反应和胰岛功能。然而,在2-OC环境中,葡萄糖的释放动力学要比在体内慢得多,这很可能是由于缺乏主要的葡萄糖消耗器官和组织,如肌肉、脑 和肾脏以及内皮细胞,基质和免疫 芯片中的细胞。此外,2-OC中2小时的介质周转时间可能对延迟有影响。
此外,我们假设,< 24小时的高血糖期可能已经在串联共培养的肝脏类器官体中诱导了脂质相关的胰岛素耐受,导致随着时间的推移观察到的葡萄糖利用率的下降。特别是,Davidson等人 研究表明,在培养6天内,原代人肝细胞胰岛素耐受的发生维持在25mm葡萄糖水平。此外,当葡萄糖浓度为12.5 mM时,脂质积累增加。
串联共培养前后的免疫组织学染色显示胰岛和肝脏类器官体保持正常形态,胰岛中胰岛素和胰高血糖素稳定表达(图2A和3C),细胞角蛋白8/18、波形蛋白、白蛋白和CYP3A4在整个串联共培养期间(图2C,E和4D,E)。此外,这些图像描述了不同类型的异体类器官等值物的稳定分布——胰岛中的α和β细胞,肝组织中的HepaRG和肝脏类器官体中的星状细胞——表明球体中有存活但不增殖的细胞。波形蛋白(星形细胞表达的细胞外基质蛋白)的均匀分布显示了15天串联共培养过程中肝脏类器官中结缔组织的持续活性。此外,白蛋白的稳定分泌和保留的CYP3A4表达支持肝脏类器官的生理表型。接种到芯片前,胰岛素通过含星状细胞的肝脏类器官中的胰岛素受体激活AKT,显示肝素球的生理相关反应(图2F)。与单层HepaRG细胞相比,受刺激和未受刺激的AKT磷酸化比例在肝脏类器官中明显更高,这表明3D培养环境有利于生理反应。
这些结果现在鼓励我们在串联共培养中诱导T2DM情况,随后导致建立的2-OC模型中T2DM的特征。因此,本文所介绍的胰岛-肝脏培养可用于揭示与T2DM疾病进展相关的机制和共病,包括β细胞衰竭、肝胰岛素耐受、脂肪变性、脂肪性肝炎和肝硬化。MOC模型的另一个发展将包括其他器官,如肾脏、心脏组织和脂肪,或不同的器官组合,这取决于正在研究的科学问题。该模型未来的改进将是用原代人肝细胞取代HepaRG细胞,以更好地反映人类肝脏的功能,并选择特定的表型和基因型。
北京佰司特贸易有限责任公司 (https://www.best-sciences.com):
类器官培养仪-HUMIMIC;质量光度计--OneMP;灌流式细胞代谢分析仪-IMOLA;便携式4通道SPR仪-P4SPR;蓝光/绿光LED凝胶成像;Nanocellect细胞分选仪-WOLF;微纳加工点印仪-NLP2000/DPN5000;
咨询
- 425
- 点赞
- 复制链接
- 举报










