从多克隆到抗原特异性调节T细胞治疗—Polyclonal vs. Antigen-Specific Treg Therapies
一. Treg 细胞简介
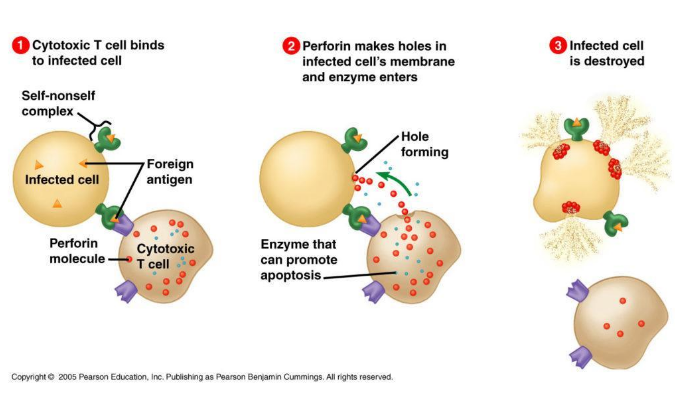
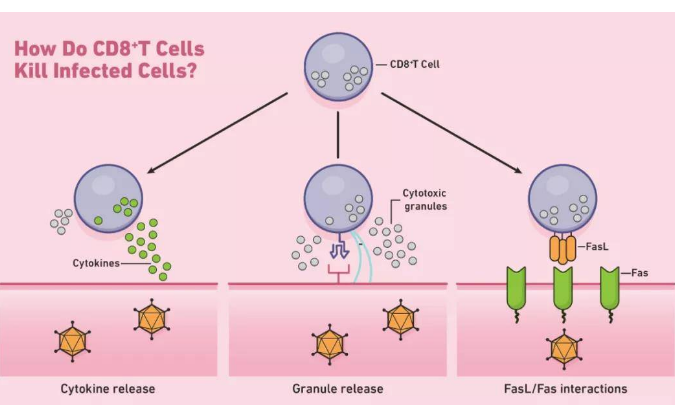
Treg细胞是T细胞的一种,占CD4+T细胞总数的5~10%,具有维持体内平衡和预防自身过度免疫的功能,其特征是CD4+CD25+FOXP3+和低水平CD127的共同表达。高水平的FOXP3和特异性去甲基化区域(TSDR)的去甲基化是Treg的显著特征,TSDR是FOXP3基因中的一个保守区域。Treg细胞分两类:天然调节T细胞(nTreg)和诱导调节T细胞(iTreg)。两类Treg都表达Foxp3。nTreg在胸腺中发育,通过细胞间接触实现抑制作用,功能是维持正常免疫耐受和控制炎症反应。iTreg来源于肿瘤微环境信号诱导的外周原始T细胞,包括肿瘤抗原、细胞因子(如IL-10, TGF-β)和其他可溶性分子。iTreg通常认为可以抑制效应T细胞(Teff)、NK细胞和DC细胞的抗肿瘤免疫作用。Treg细胞主要有以下五种功能机制:1.Treg分泌抑制性细胞因子(包括 IL-10、TGF-β 和 IL-35);2.Treg通过颗粒酶和穿孔素杀死效应细胞。3.Treg影响效应细胞的功能:Treg与效应T细胞竞争消耗 IL-2,从而抑制效应T细胞的生长,Treg通过产生胞外酶CD39和CD73促进TME中腺苷的产生,诱导效应细胞的抑制和抗增殖作用,Treg通过缝隙连接(gap junction)将大量cAMP转移到效应T细胞,干扰其代谢。4.Treg通过刺激性和抑制性受体(CTLA-4 或 LAG3)诱导DC耐受,后者通过IDO进一步抑制T细胞的能力。5.MDSCs和Treg产生的因子形成正反馈环,促进增殖,增强抑制环境(图1)。
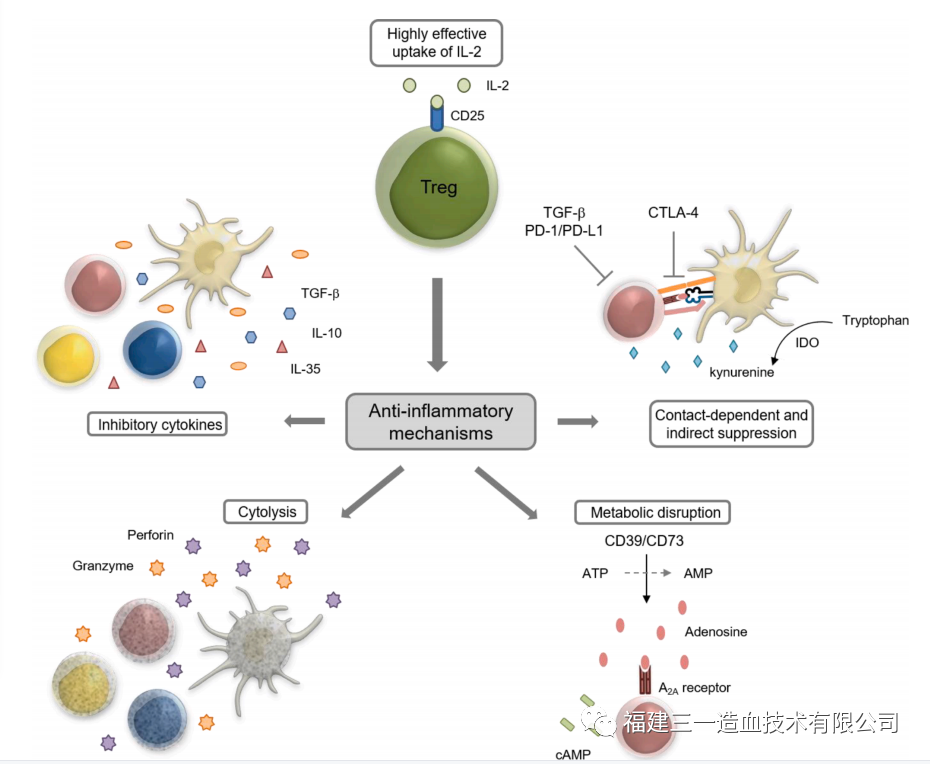
图1 Treg 细胞作用机制(Ibo et al 2020)
二. 从多克隆到抗原特异性Treg 细胞
目前研究治疗所使用的Treg疗法可以分为体内(in vivo)及体外(in vitro)疗法,从细胞特异性角度可以分为多克隆和抗原特异性Treg疗法(图2)。
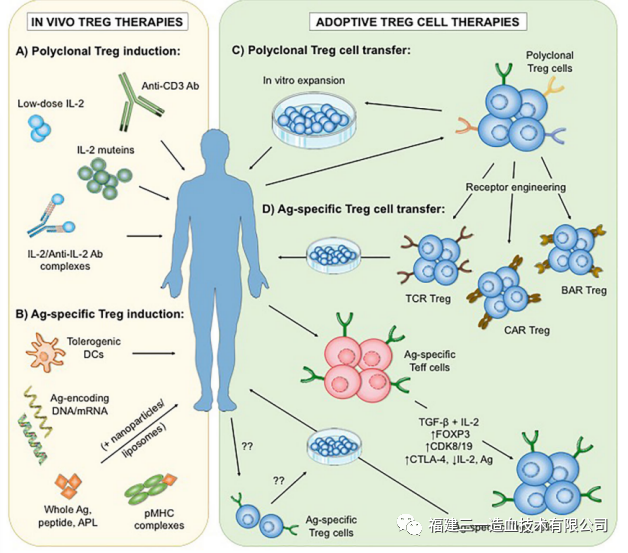
图2.多克隆和抗原特异性T细胞疗法
最初Treg过继性细胞疗法的临床试验主要使用多克隆或体外扩增的Treg细胞。首次使用经体外扩增的Treg治疗GVHD的研究报告表明,慢性GVHD患者症状得到缓解,并可减少免疫抑制剂的使用。几年后,11名接受造血干细胞移植治疗恶性血液病的GVHD患者,使用扩增后的脐血Treg细胞治疗,发现患者II-IV级急性GVHD的发病率降低5倍,Treg治疗组一年后无慢性GVHD,而对照组为14%。尽管Treg细胞治疗获得了令人鼓舞的临床效果,但是多克隆Treg细胞存在非特异性免疫抑制的风险。这个问题可以通过使用抗原特异性Treg细胞来克服,与多克隆Treg细胞相比,抗原特异性Treg细胞只需要较少的细胞就可以实施更多的局部和靶向抑制。在动物模型研究中证明,抗原特异性Treg细胞在功能上优于多克隆或未修饰的Treg细胞。目前产生抗原特异性Treg的方法,主要依赖于用APC和特异性抗原扩增,或在体外制备Car-Treg(图3)以及TCR-Treg。而在前述三种方法中,传统的用APC扩增Treg效率较为低下,TCR-Treg受到MHC的限制,限制了针对不同患者的普适性应用。
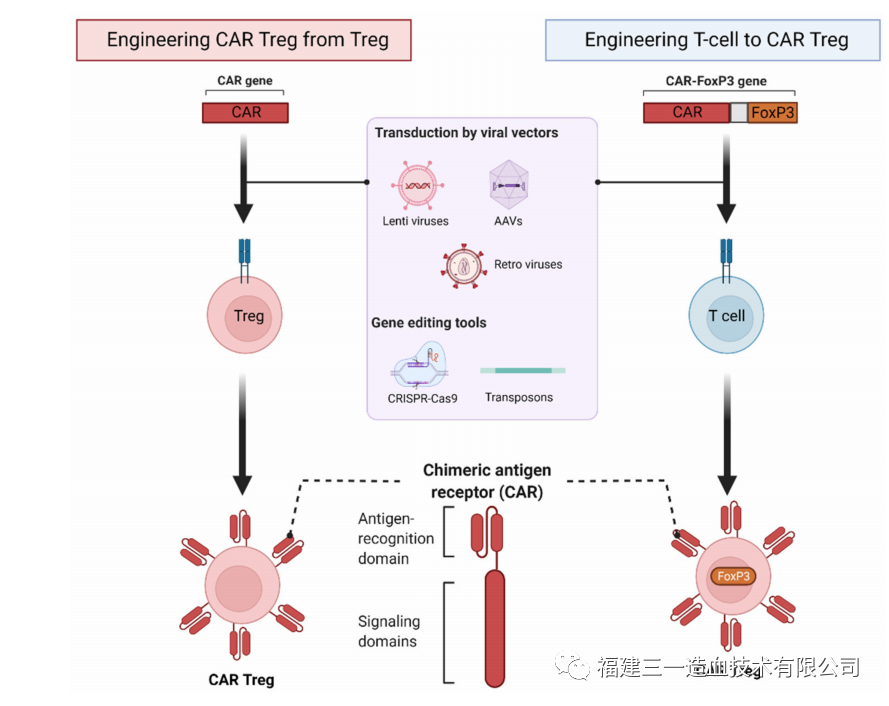
图3Car-treg 细胞的生成(Arjomandnejad et al 2022)
而CAR-Treg具有独特的优势:表达CAR的T细胞激活时,可以绕过HLA限制;通过共受体信号的激活增加了特异性;CAR的靶向灵活性(任何可溶性或表面多价抗原都可以作为靶点)。CAR-Treg细胞最直接的应用是GvHD和器官移植排斥反应。与大多数自身免疫性疾病不同,器官移植中有非常明确的靶点(即HLA分子)。2016年,首次报道了HLA-A2 CAR-Treg细胞。研究证明,HLA-A2-CAR-Treg细胞抑制Teff细胞增殖,并在免疫缺陷NSG小鼠模型中阻止了HLA-A2+PBMC介导的GVHD。CAR-Treg细胞新的应用方向仍在出现,B细胞靶向抗体受体Treg细胞(即BAR-Treg)是研究热点,例如在A型血友病中,人VIII因子(FVIII)注射液用于治疗A型血友病患者,而随着时间的推移,抗FVIII中和抗体的发展会导致发病率和死亡率上升。含有FVIII免疫显性结构域(A2或C2)作为胞外结构域的BAR被设计成靶向FVIII特异性B细胞,细胞内信号结构域仍为CD28-CD3ζ。在体外,展示A2结构域或C2结构域的人BAR-Treg细胞抑制了用重组FVIII免疫的小鼠产生抗FVIII抗体。
三. 抗原特异性Treg疗法在自身免疫性疾病的作用
1.移植物抗宿主病
Treg治疗已成为GVHD研究的重要领域,主要集中于经体外扩增的Treg。治疗GVHD首次临床试验显示,Treg对急性GVHD症状影响不大,但显著缓解了慢性GVHD的症状,并减少了免疫抑制剂的使用。研究者设计用于表达HLA-A2-特异性CAR-Treg,在体外和体内试验中,A2-CAR-Treg保持FoxP3、CD25、Helios和CTLA-4的高表达。此外,研究者在免疫缺陷小鼠模型中预防了异种GVHD。继HLA-A2靶向CAR-Treg成功后,最近的研究重点是产生具有不同靶向结构域(如CD83)的CAR-Treg,可在小鼠模型中预防GVHD。还有CD19,其可抑制B细胞抗体的产生。
这些有意义的前期研究结果促使了全球首次CAR-Treg用于缓解肾脏移植的临床试验(NCT04817774)的进行。这项试验结果支持CAR-Treg在临床试验中效果优于体外扩增的多克隆Treg,进一步扩大在其他疾病条件下使用CAR-Treg的可能性。随后,更多的生物技术公司进入到Car-Treg领域,如Quell Therapeutics专注于肝移植受者的CAR-Treg。
2.1型糖尿病
1型糖尿病(T1D)是一种自身免疫性疾病,其特征是由于胰腺β细胞的破坏而导致胰岛素缺乏。研究表明,T1D患者中Treg的免疫抑制功能降低。在动物模型中,输注扩增的抗原特异性Treg在阻断和逆转糖尿病方面显示出有希望的结果。然而,由于在血液循环中罕见,分离足够多的抗原特异性Treg具有挑战性。因此,研究重点是用FoxP3基因转导的多克隆CD4+T细胞,将其转化为Treg。此外,可通过工程化TCR或CAR技术将抗原特异性赋予多克隆T细胞。Brusko的研究小组发现,谷氨酸脱羧酶(GAD)特异性TCR转导的Treg在体外可以抑制抗原特异性T细胞增殖的能力。另一项研究中,Hull等人将胰岛特异性TCR转移到调节性T细胞,并证实其在体外具有抑制CD4和CD8 T细胞增殖的能力。目前,GentiBio和Abata等公司正在开发TCR工程化Treg治疗T1D。
3.类风湿性关节炎
类风湿性关节炎(RA)是最常见的炎性关节炎,其特征是滑膜炎症、增生、自身抗体产生、软骨和骨破坏。多种免疫细胞亚群参与RA的发展,其中,T细胞和巨噬细胞之间的相互作用起着至关重要的作用。Wright等人利用卵清蛋白(OVA)特异性Treg,通过产生TCR-Treg或TCR-FoxP3转导的CD4+T细胞,来抑制OVA诱导的关节炎。两种TCR-Treg均通过旁观者抑制对不同抗原特异性T细胞的增殖表现出OVA依赖性的抑制。目前,Sonoma Biotherapeutics公司正在开发针对RA的CAR-Treg疗法。
4.多发性硬化症
多发性硬化(MS)是一种自身免疫性脱髓鞘和神经退行性疾病,由识别髓鞘表位的自身反应性T细胞引起。使用实验性自身免疫性脑脊髓炎(EAE)模型进行的临床前研究证实了Tregs抑制抗原特异性自身反应性免疫反应的有效性。Fransson等人用CAR靶向髓鞘少突胶质细胞糖蛋白(MOG)创建抗原特异性Treg。MOG-CAR Tregs在体外抑制了效应T细胞的增殖。在体内,MOG-CAR Tregs减少了EAE小鼠的疾病症状,并减少了脑组织中的促炎细胞因子mRNA水平。后来,Kim等人利用源自MS患者的髓鞘碱性蛋白特异性TCR构建了Treg,在体内TCR-Tregs显著降低了EAE-MS小鼠模型中的疾病评分。免疫调节工程化Treg在临床前研究中的结果,促进了一些生物制药公司的CAR-Treg的开发,如Abata Therapeutics和TeraImmune。
5.炎症性肠病
炎症性肠病(IBD)是以胃肠道慢性炎症为特征的疾病,溃疡性结肠炎(UC)和克罗恩病(CD)是IBD最常见的形式。研究表明,肠道微生物群和免疫反应之间的不平衡在IBD中起着重要作用。通常,肠道炎症与Treg数量的减少无关。然而,Treg活性不足的小鼠更容易发生严重结肠炎。因此,多项研究试图利用Treg抑制活性来维持UC的耐受性。在一项研究中,来自转基因小鼠的针对已知结肠炎抗原(TNP)的CAR-Tregs在体外抑制了效应T细胞的增殖。在体内,诱导结肠炎后,与野生型动物相比,观察到使用CAR-Treg转基因小鼠的存活率增加。此外,将TNP-CAR Tregs转移到结肠炎小鼠模型中可以减少症状并提高存活率。基于CAR-Treg细胞的治疗可能是缓解UC和CD的一种有前途的有效治疗方式。
6.哮喘
哮喘是一种慢性呼吸道疾病,哮喘患者的Treg受损并减少。因此,新方法专注于通过在哮喘临床前模型中使用调节性T细胞来预防气道炎症。此外,一项研究利用调节T细胞表位(Tregitopes)诱导高度抑制性过敏原特异性Treg。用Tregitopes治疗可抑制过敏原诱导的气道高反应性和肺部炎症。为了将Treg导向哮喘相关抗原,Skuljec等人应用CAR技术,从转基因小鼠中分离出针对CEA的第二代Treg,CEA是一种存在于肺和胃肠道腺上皮表面的糖蛋白。他们的结果显示了哮喘小鼠炎症肺中CEA-CAR Tregs的激活和归巢。与未修饰的Tregs相比,CEA-CAR Tregs在更大程度上改善了炎症。
四.抗原特异性调节T细胞疗法面临的挑战及策略
1. 缺乏明确的特异性抗原及靶向性:为了开发有效的抗原特异性Treg细胞治疗,必须很好地鉴定和表征与疾病相关的自身抗原。然而,上述许多自身免疫性疾病(AID)尚未实现这一点,包括多发性硬化症和银屑病等。而且,精准抗原的鉴定也受到初始组织损伤后可能存在的抗原扩展(antigen spreading)的限制和影响,这可能会阻碍基于单个抗原的治疗的成功,虽然这个障碍可能可以通过同时靶向多个自我抗原(如果适用)来克服,但同时鉴定多种自我抗原也是技术难度较高的工作。同时,也有一些研究表明无需精确确定疾病起始抗原,因为一些研究表明只要实施的干预因素导致活化的Treg细胞在受影响的炎症组织中积累,从而能够以与抗原接触无关的方式诱导其他免疫调节群体,那么确定疾病起始抗原可能并不是必须的。这种“感染耐受”(infectious tolerance)已经在小鼠结肠炎模型中观察到,其中TNP特异性CAR Treg细胞能够减少2,4,6-三硝基苯磺酸(TNBS)诱导的结肠炎。此外,通过转基因引入适当的活化Treg细胞迁移到疾病特异性发炎部位所必需的表面分子可以进一步增强Treg细胞抑制效应,虽然Treg细胞运输到特定组织的关键信号仍然需要更多研究阐明,但已有研究表明淋巴细胞需要趋化因子受体CXCR3的表达,以便回到MS患者的大脑和T1D患者的胰岛。因此,通过工程化CXCR3组织特异性Treg细胞,可以增强这些AID中Treg细胞给药的靶向性(功效)和耐受性。另一方面,患有银屑病的患者可能受益于表达归巢受体CCR4和皮肤淋巴细胞抗原(CLA)的Treg细胞,这是迁移到皮肤所必需的。
2. 抗原特异性Treg的安全性及稳定性:关于Treg细胞输注进行体内免疫调节干预的安全性仍然存在不确定性,必须谨慎研究对待。特别是体外产生的(多克隆或抗原特异性)Treg细胞在体内稳定性和抑制功能是Treg疗法有效性的重要基础。添加小分子物质已被证明可以增强iTreg细胞在体外的稳定性,同时基因编辑手段也可用于在炎症环境中更好维持Treg细胞的稳定性,这种潜在的策略可能包括使FOXP3过表达,或敲除存在于自身免疫发炎组织中的促炎信号通路中的分子。值得注意的是,尽管在许多AID中Treg缺乏症的潜在机制尚不清楚,但有研究已经报道了像IL-12和IL-6这样的细胞因子可以在体外诱导Treg功能缺陷。因此,结合这些细胞因子的受体的消融可以一定程度上改善或避免Treg的功能缺陷。此外,基因工程方法还可以整合自杀基因,这些自杀基因可以在疾病进展或由有害免疫抑制引起的严重不良事件(例如癌症发展或慢性感染)的情况下激活发挥作用从而增强产品的可控性和安全性。另一方面,Treg细胞与免疫调节药物联合应用可以减少自身免疫性炎症或维持Treg稳定性,降低体内Treg不稳定的风险。研究报告表明,与CD3抗体的联合使用能够改善T1D小鼠模型胰岛中自身抗原特异性Treg细胞的植入。促进FOXP3胰岛素特异性Treg细胞的扩增,并且在鼻腔给予胰岛素原联合CD3抗体治疗后,小鼠自身免疫性糖尿病的缓解更有效。
3. 抗原特异性Treg细胞的作用机制仍有待厘清:目前各项研究报导鉴定的抗原特异性Treg细胞的转录因子例如T-bet,GATA-3或视黄酸受体相关孤儿受体γ(RORγt)和细胞表面分子(包括共抑制/共刺激受体,如PD-1和T细胞可诱导共刺激分子(ICOS)以及趋化因子受体包括CXCR3和L-选择素(CD62L)在表达均存在差异。此外,Treg细胞可以通过多种机制介导其免疫抑制作用,包括分泌抗炎细胞因子,IDO,颗粒酶以及胞外酶(ectoenzymes)的研究结果也存在差异。这表明在不同时间点和组织中FOXP3 Treg细胞亚群可能具有并不完全一样的作用机制和功能,这种现象可能取决于不同抗原特异性Treg细胞的发育起源,它们控制的免疫反应类型(Th1,Th2或Th17介导的炎症),或者它们所在的组织有所不同。此外,在健康个体的多个非淋巴组织和器官(例如皮肤,肠道,肺,肝脏,脂肪组织和骨骼肌)中发现了组织驻留的Treg细胞,它们可以控制局部炎症,但也可以通过独立于其免疫抑制功能的机制在非炎症环境中促进正常的组织稳态。然而,组织驻留Treg细胞在健康和自身免疫期间的关键维持因素和特征在很大程度上仍然是未知的。因此,抗原特异性Treg细胞的作用功能和机制仍有待大量深入研究厘清,目前还不确定抗原特异性iTreg细胞或基于抗原的治疗是否可以诱导Treg介导的免疫调节和组织稳态的组织特异性机制。
4. 不同AID疾病或个体抗原特异性Treg细胞的数量和/或功能缺陷有待厘清:AID中抗原特异性Treg细胞的数量和/或功能缺陷的根本原因尚不清楚,不同AID疾病抗原特异性Treg缺陷存在不同,即使患有类似疾病症状的患者之间抗原特异性Treg缺陷也可能有所不同。在进行自体细胞治疗时候,这是一个特别要重点考虑的因素,因为使用潜在的有缺陷的自体Treg细胞可能不会产生所需的治疗结果。因此,在抗原特异性Treg细胞的体外生成/扩增期间,识别个体中的特异性Treg缺陷并进行修复非常重要。这种个性化策略可能包括导入对Treg存活和稳定性比较重要的分子的基因编辑(例如涉及IL-2信号传导和FOXP3表达的信号通道)以及插入潜在未表达的趋化因子受体(例如CXCR3,CCR4,CLA),以提高它们迁移到疾病相关组织的能力,此外,同种异体通用性抗原特异性Treg细胞研发制备也是未来十分重要的一个选项。
五.总结
目前,Treg细胞治疗自身免疫性疾病正方兴未艾,抗原特异性Treg细胞疗法表现出独特的优势,具有极大的潜力,为了开发安全有效的抗原特异性Treg疗法,需要进一步深入研究生理稳态和自身免疫发病期间Treg细胞的生物学机制。这需要新的策略来表征不同的Treg亚群,更好的方法来识别疾病相关的特异性抗原和Treg细胞缺陷。特别是新的Treg细胞生物标记和示踪技术可以监测体内输注或内源性Treg细胞的迁移行为和功能,对于发现可能限制Treg疗法益处的潜在问题是十分必要的。此外,AID患者可能需要基于特定个体的Treg治疗,这些治疗依赖于识别个体潜在的Treg数量和功能缺陷特征,尽管这项工作十分有难度,但这个问题可能可以通过使用具有MHC匹配的同种异体通用性Treg群体来进行纠正。随着研究人员不断努力开发新的技术以优化Tregs的设计,以及与合成生物学和基因编辑的联合使用,未来对控制Treg功能,稳定性维持的分子和细胞机制了解会进一步加深,预期可以开发出更安全有效的Treg 疗法。
|
货号 |
产品名称 |
作用 |
备注 |
| FLOSEP-C-004P |
人CD4+细胞分选试剂盒 |
体外培养获得大量高纯度CD4+细胞 |
正选 |
| FLOSEP-C-004N |
人CD4+细胞分选试剂盒 |
体外培养获得大量高纯度CD4+细胞 |
负选 |
|
CT-011 |
人Treg细胞体外高效扩增试剂盒 |
从CD4+起始细胞体外培养获得大量高纯度Treg细胞(CD4+CD25+FOXP3+) |
咨询
- 476
- 点赞
- 复制链接
- 举报