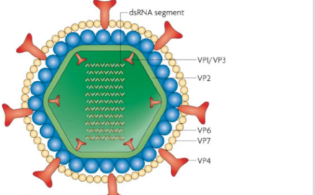
扬帆出海 | 瀚海新酶6种生药制药原材料完成DMF备案

美国联邦食品、药品和化妆品法规定,药品在上市之前,申报者必须向FDA提出一系列申请,比如临床研究申请(IND)、新药注册(NDA)和生物制品许可证申请(BLA)等,并需要提供该药物在安全性、有效性和质量三方面的全部信息,其中涉及到原料药、辅料的相关技术内容,但是准备这些材料无疑会耗费大量的时间和精力,因此会严重影响临床申报的进程。

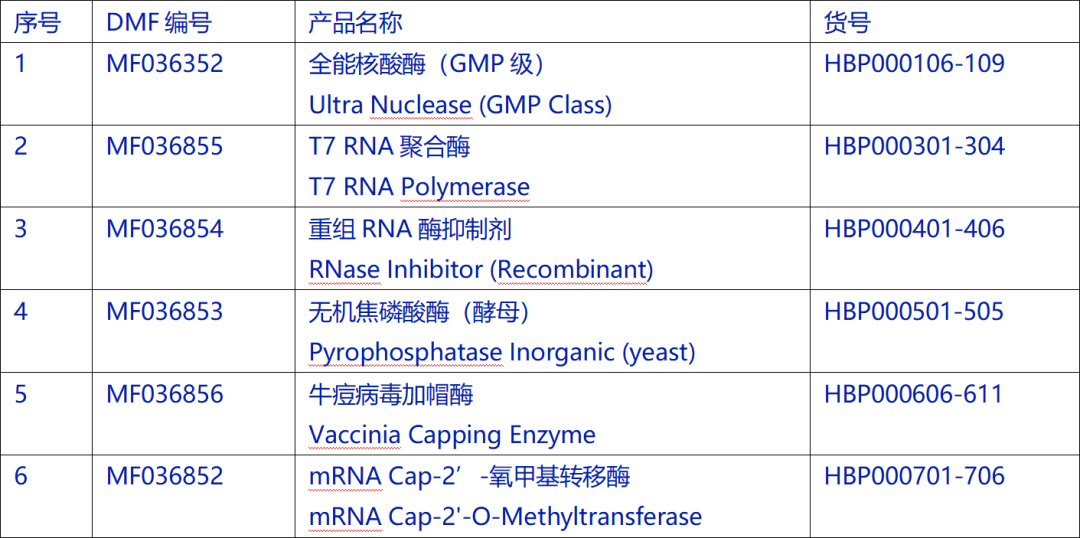
瀚海新酶完成DMF备案的产品简介:
一、GMP级全能核酸酶:生物制药行业首选核酸去除剂
无动物源性:符合国家药典对于生物制品病毒安全性控制的要求
严格质控:HCP、微生物、内毒素、金属离子残留低,高度的批间一致性
稳定性好:优越的热稳定性
使用无忧:配套高灵敏度检测试剂盒定量检测残留
附:全能核酸酶检测试剂盒2.0(ELISA法)(货号:HBP000116):用于定量检测全能核酸酶的残留
灵敏度高:最低定量限低至0.02ng/mL,检出限<0.01 ng/mL
精密度好:批内CV<10%、批间CV<10%
操作简便:包被板即开即用,反应时间缩短0.5-1小时
二、GMP级mRNA系列酶
1、T7 RNA聚合酶:利用大肠杆菌重组表达的 T7 RNA 聚合酶,具有高度特异性,高效合成mRNA
转录模板长度可以达到10K以上,对微量模板仍具有转录功能
2、重组RNA酶抑制剂:大肠杆菌重组表达鼠源RNA酶抑制剂,通过特异性结合抑制RNase A,B,C的活性,保护RNA不被降解
酶活稳定,-20℃冻融酶活不受影响
酶活性高,高倍稀释后仍保持较高酶活性
3、无机焦磷酸酶(酵母):大肠杆菌重组表达,水解核酸扩增实验中产生的无机焦磷酸盐,避免其对反应体系的抑制,提升IVT、PCR等反应产物产量
通用性强,适用于DNA、RNA以及蛋白质合成体系
4、牛痘病毒加帽酶:大肠杆菌重组表达牛痘病毒来源,将7-甲基鸟苷酸帽子结构(Cap0)加到RNA的5’端,提升mRNA稳定性及翻译效率,并且可降低mRNA的免疫原性
加帽效率超过95%,mRNA在细胞内稳定表达
5、mRNA Cap-2'-氧甲基转移酶:大肠杆菌重组表达,特异性将甲基化供体SAM的甲基转移至RNA中的Cap0结构上形成Cap1结构,提升mRNA的翻译效率
体外加帽可避免体内免疫反应


咨询
- 388
- 点赞
- 复制链接
- 举报