靶点人源化大鼠
- rat
- 百奥动物
- 江苏省南通市
- 现货
- 按需
- 议价
- 2025-11-21 15:04:12
百奥赛图江苏基因生物技术有限公司
在药物研发不断加速的当下,“如何提高临床转化率”已经成为制药企业与科研团队的共同关注点[1]。随着候选药物结构的复杂化、抗体类型的多样化以及研究需求的精细化,传统的小鼠模型虽然依旧是药理和免疫学研究的主力,但在某些研究环节上,已经难以完全满足前期研究对于精度和临床相关性的需求。
在这一背景下,随着基因编辑技术的不断完善,大鼠模型的应用正逐渐快速增长。大鼠并非简单的“大号小鼠”,凭借更接近人类的生理特征、更充足的取样量、更低的药物清除率以及更丰富的免疫学反应谱,大鼠模型正被越来越多地用于药物药代动力学(PK)和药效学(PD)、安全性评价及疾病机制等研究,为临床预测性更强的药物研发提供了新的科学工具[2]。
大鼠模型的价值:以“大体积”开启“大洞察”
相比小鼠,大鼠拥有更大的体型和器官体积,这带来一系列实验上的优势:
- 取样更充足:大鼠体重及血容量大约是小鼠的10倍,使得在同一动物体内可以实现更密集时间点的血液和组织样本采集,有利于获得高质量的PK和PD数据[2]
- 免疫系统更复杂:在研究免疫反应、补体通路及慢性炎症等疾病模型时,能更好地反映人类反应以提供更高的参考价值[1]
- 神经和行为学研究更具优势:大鼠的学习记忆和复杂行为模式更丰富,它们相对较大的脑容量也便于脑部手术和精细神经操作[3]
- 外科操作和植入研究更灵活:更大的体型使其成为药物缓释系统、基因治疗或神经、代谢研究等复杂实验的理想模型[3]
百奥赛图基于多年基因编辑模型构建经验,开发了覆盖不同研究领域的人源化大鼠模型,涵盖药物代谢、免疫到神经系统研究,构成了一个贯穿早期发现至临床转化的多维模型体系,为不同研发阶段提供更具临床相关性的实验解决方案。
B-hTFR1大鼠:突破血脑屏障的神经药物递送模型
血脑屏障(BBB)是神经药物研发面临的最大挑战之一。它有效保护中枢神经系统免受外界干扰,却也阻止了大多数大分子药物的进入。TFR1(铁传递蛋白受体1) 是一种在脑微血管内皮细胞上高表达的受体,可通过受体介导的跨膜转运(Receptor-Mediated Transcytosis, RMT)实现物质从血液进入脑组织。B-hTFR1大鼠搭载人源TFR1基因,在脑内皮细胞上真实再现人源TFR1的表达分布与结合特性。此模型可以系统评估药物在脑部的暴露分布、递送效率与功能影响,为脑靶向治疗提供更可靠的实验依据。
➤ B-hTFR1大鼠的TFR1蛋白表达分析
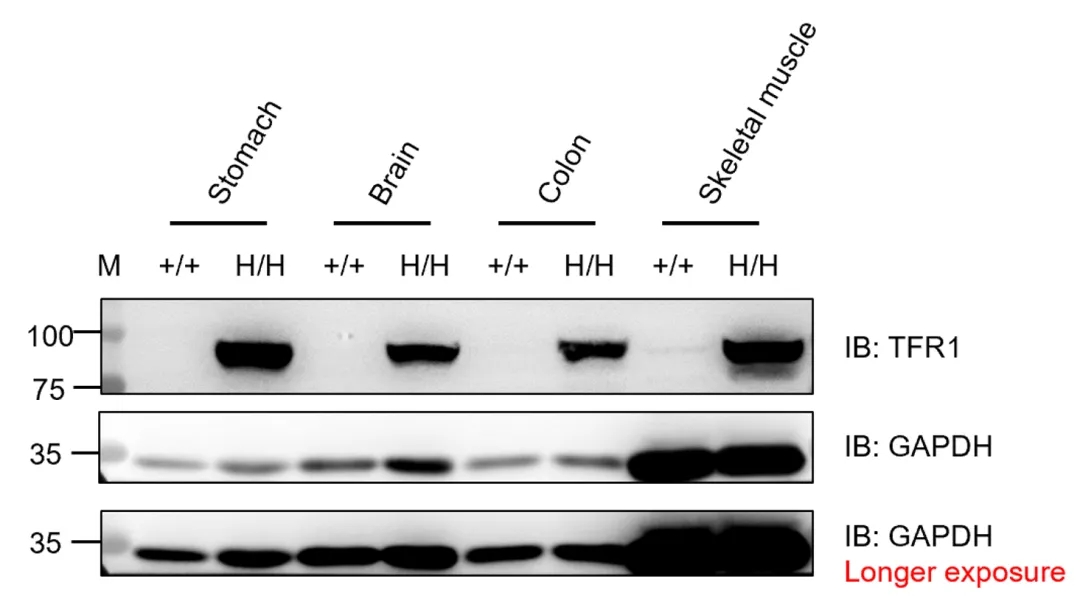
通过Western blot分析野生型SD大鼠和纯合B-hTFR1大鼠中TFR1蛋白的表达。从野生型SD大鼠(+/+)和纯合B-hTFR1大鼠(H/H)中收集多种组织,使用抗TFR1抗体(Abcam, ab214039)进行WB分析。取40μg总蛋白用于加样。GAPDH作为内参。结果显示,人源TFR1仅在纯合B-hTFR1大鼠的胃、脑、结肠和骨骼肌中可检测到。M为分子量标记。
➤ B-hTFR1大鼠的TFR1 mRNA表达分析
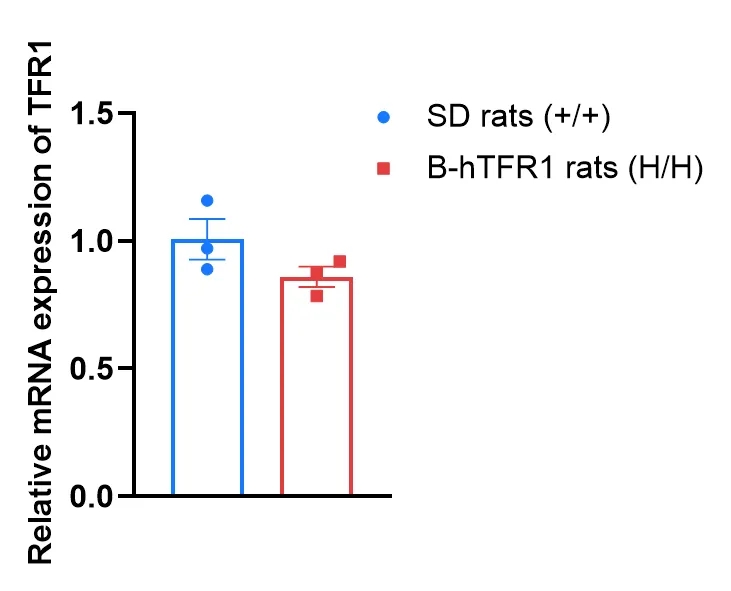
通过RT-qPCR分析野生型SD大鼠与B-hTFR1大鼠中TFR1 mRNA的品系特异性表达。所有大鼠均经PBS灌流后处死。从野生型SD大鼠(+/+)和纯合B-hTFR1大鼠(H/H)(n=3,5周龄,雄性)的脑组织中提取RNA,经反转录合成cDNA后,使用TFR1引物进行PCR扩增。结果显示,纯合B-hTFR1大鼠脑组织中TFR1的表达水平与野生型SD大鼠接近。
B-hFcRn大鼠:抗体药代与半衰期延长验证的关键模型
随着单抗和双抗药物的不断发展,抗体在体内的循环与代谢行为已成为研发早期关注的焦点。FcRn(新生儿Fc受体)是调控IgG抗体体内循环的关键受体,通过pH依赖性结合与释放IgG,从而延长其半衰期。但传统鼠源FcRn与人源IgG的亲和力存在明显差异,导致临床前数据常难以准确反映人体药代特征。B-hFcRn大鼠通过将人源FcRn基因精确敲入大鼠基因组,真实再现人类FcRn与IgG之间的结合特征,使其成为抗体半衰期、PK分析与Fc修饰验证的理想模型。凭借大鼠更大的血样量和可重复采样能力,以及较低的药物清除率,B-hFcRn大鼠能够获得高分辨率的PK曲线,为抗体工程优化与早期药物选择提供更可靠的数据支撑。
➤ B-hFcRn大鼠的蛋白表达分析
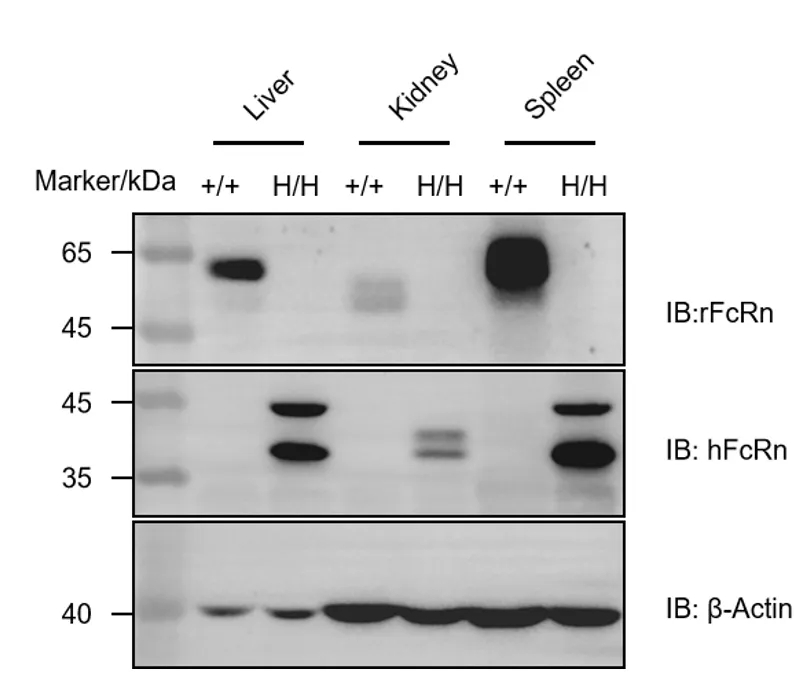
纯合B-hFcRn大鼠中FcRn蛋白的WB分析。从野生型SD大鼠(+/+)和纯合B-hFcRn大鼠(H/H)收集多种组织裂解液,并使用种属特异性抗鼠FcRn抗体和抗人FcRn抗体进行WB分析。取40μg总蛋白用于加样。结果显示,鼠源FcRn仅在野生型SD大鼠中可检测到;人源FcRn则仅在纯合B-hFcRn大鼠的肝脏、肾脏和脾脏中可检测到。
➤ 抗体药物在B-hFcRn大鼠中的血清半衰期
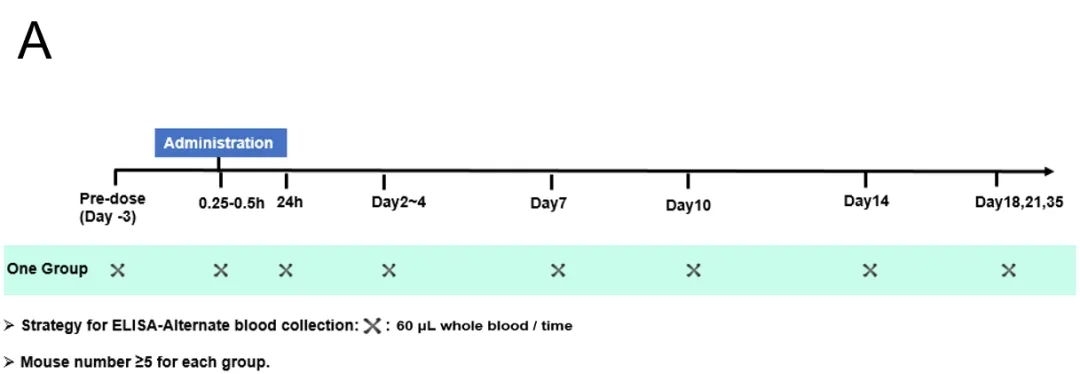
 Bevacizumab在B-hFcRn大鼠中的PK研究。野生型SD大鼠和B-hFcRn大鼠通过静脉注射Bevacizumab(商业化),并收集血清进行PK分析(n=6)。A. 血液采样时间设计,B. PK曲线,C. PK参数。数据以均值±SEM 表示。B-hFcRn大鼠模型可预测IgG抗体在人体中FcRn介导的PK及药效。
Bevacizumab在B-hFcRn大鼠中的PK研究。野生型SD大鼠和B-hFcRn大鼠通过静脉注射Bevacizumab(商业化),并收集血清进行PK分析(n=6)。A. 血液采样时间设计,B. PK曲线,C. PK参数。数据以均值±SEM 表示。B-hFcRn大鼠模型可预测IgG抗体在人体中FcRn介导的PK及药效。
B-hC3*R102G大鼠:解析补体通路与免疫炎症机制
补体系统是先天免疫的重要组成部分,其失衡或异常激活与多种免疫性疾病密切相关,包括系统性红斑狼疮(SLE)、IgA肾病、黄斑病等。在补体级联反应中,C3是核心节点,控制着炎症激活、病原清除与免疫复合物沉积等关键过程。B-hC3*R102G大鼠搭载人源C3基因并引入R102G突变(对应人类C3F变体),可模拟人类C3的结构与功能差异,成为研究补体活化机制及药物调控作用的理想工具。此模型在人源化背景下展现出与人类更一致的免疫反应,帮助在临床前阶段更精准地预测药物的炎症调控作用。
➤ B-hC3*R102G大鼠的蛋白表达分析
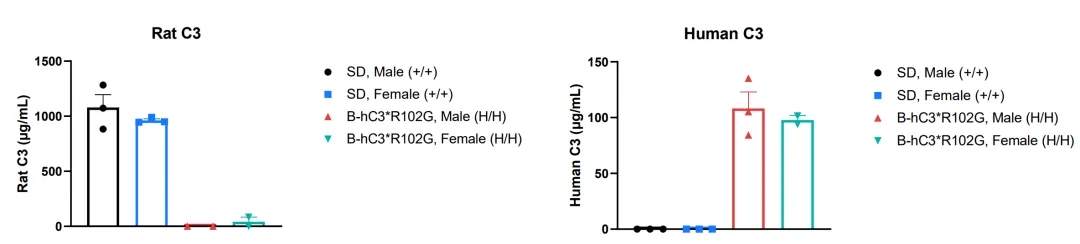
通过ELISA分析野生型SD大鼠与B-hC3*R102G大鼠的品系特异性人源C3表达。从野生型SD大鼠(+/+)(雄性、雌性,n=3,10周龄)和B-hC3*R102G大鼠(H/H)(雄性、雌性,n=2-3,10周龄)收集血清。使用ELISA分析鼠源C3表达水平(Abcam, ab157731),使用ELISA分析人源C3表达水平(Abcam, ab108823)。结果显示,鼠源C3仅在野生型SD大鼠中可检测到,而在B-hC3*R102G大鼠中未检测到;人源C3仅在B-hC3*R102G大鼠中可检测到,在野生型SD大鼠中未检测到。
➤ B-hC3*R102G大鼠的mRNA表达分析
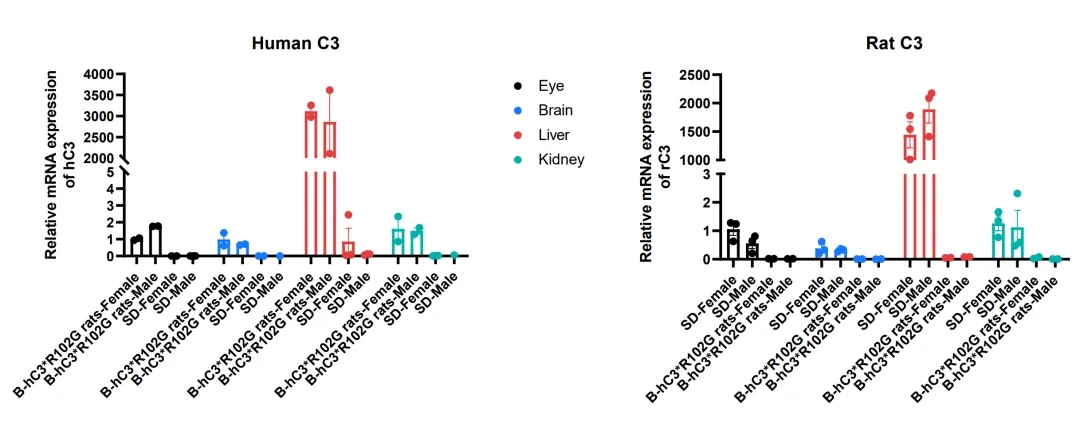
通过RT-qPCR分析野生型SD大鼠与纯合B-hC3*R102G大鼠的C3 mRNA表达。从野生型SD大鼠(+/+)和纯合B-hC3*R102G大鼠(H/H)(雄性和雌性,n=2-3)的脑、肝、肾和眼组织中提取RNA。经反转录合成cDNA后,使用鼠源或人源C3引物进行RT-qPCR分析。
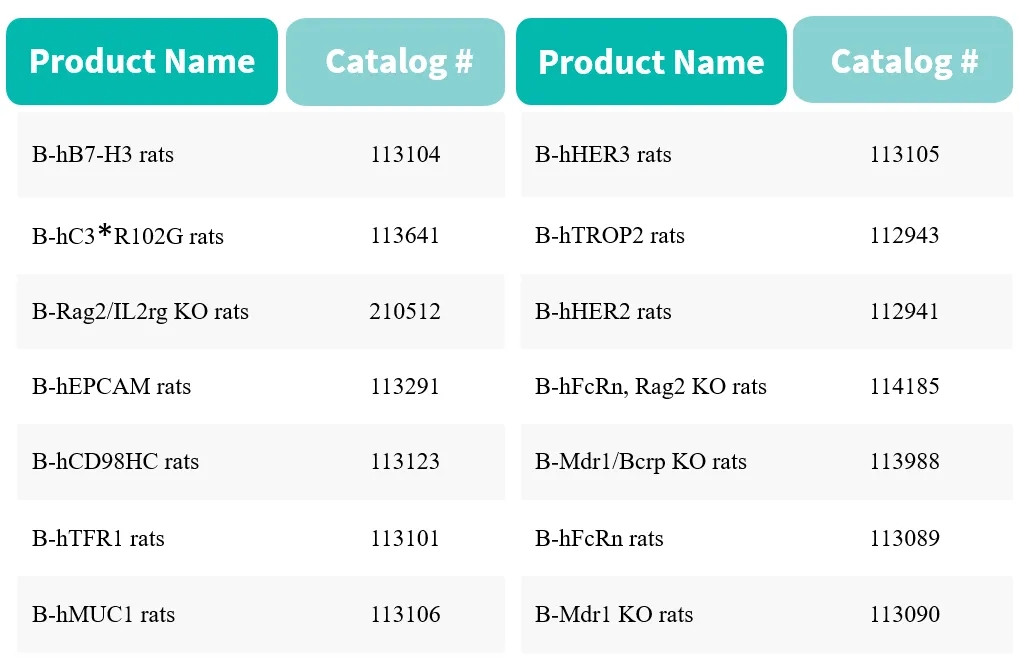
百奥赛图的靶点人源化大鼠模型(部分展示)
参考文献:
1. Vanmeerbeek I, Naulaerts S, Garg AD. Reverse translation: the key to increasing the clinical success of immunotherapy? Genes and Immunity 2023;24:217-219.
2. Robarge JD, Budge KM, Her L, Patterson AM, Brown-Augsburger P. Rat as a predictive model for human clearance and bioavailability of monoclonal antibodies. Antibodies 2025;14(1):2.
3. Zhang KK, Matin R, Gorodetsky C, Ibrahim GM, Gouvenia FV. Systematic review of rodent studies of deep brain stimulation for the treatment of neurological, developmental and neuropsychiatric disorders. Translational Psychiatry 2024;14:186.