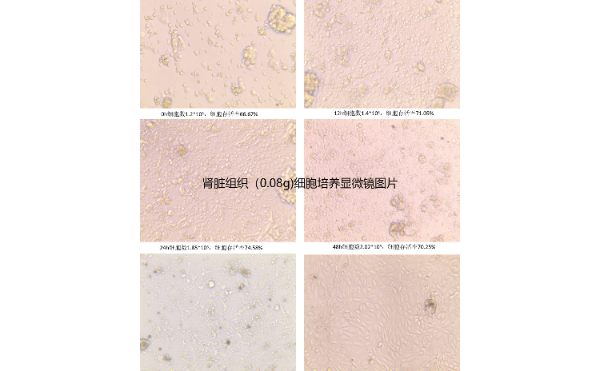
三维细胞培养技术的发展
三维细胞培养技术是在二维细胞培养和动物实验模型的基础上发展起来的简单、有效的细胞培养方式。利用三维细胞培养技术可以更好的模拟体内微环境,为相关研究领域提供新的手段。目前,三维细胞培养技术在组织工程、肿瘤学、再生医学和干细胞生物学等研究领域均有应用。该文就近年来三维细胞培养技术的发展进行综述。
摘要 三维细胞培养技术是在二维细胞培养和动物实验模型的基础上发展起来的简单、有效的细胞培养方式。利用三维细胞培养技术可以更好的模拟体内微环境,为相关研究领域提供新的手段。目前,三维细胞培养技术在组织工程、肿瘤学、再生医学和干细胞生物学等研究领域均有应用。该文就近年来三维细胞培养技术的发展进行综述。
关键词 三维细胞培养技术
目前,体外细胞水平的研究很大程度上是在二维培养条件下完成的;在体内,主要在实验动物模型体内完成。二维细胞培养技术培养的细胞在体外环境下逐渐丧失了其体内原有的性状,在形态、结构和功能方面都与其在体内自然生长的状态相去甚远;而动物实验由于体内的多种不可控因素的制约以及体内和体外环境相互影响而变得复杂化,不利于探究具体机制。鉴于两者均存在一定的局限,近年来发展了三维细胞培养技术(three-dimensional cell culture, TDCC),这种培养方法获得的细胞在形态结构、增殖分化、基因表达及细胞的功能活动等方面均与二维培养存在显著不同。三维细胞培养既能保留天然细胞微环境的物质结构基础,又能更好的模拟体内细胞生长的微环境,克服了之前两种方式的缺陷,为细胞水平的研究提供了一种更简单、更安全、更可靠的方法。如何能够维持干细胞的自我更新并使其定向分化是干细胞研究的两个基本问题。目前,绝大多数干细胞相关研究均使用二维平面培养体系,但干细胞在体内的生长、分化微环境应为三维体系。干细胞的分化及其发育方向与其所处微环境紧密相关,而体外三维培养体系能够更好的模拟干细胞的体内生长环境,并能够为组织工程研究提供更加准确可靠的实验数据。肿瘤细胞在特定时间、空间条件下能够产生与其发生和发展密切相关的特定表型、结构和生长行为。二十世纪70年代的研究表明,肿瘤的发生与肿瘤所处的微环境密切相关。在动物体内肿瘤细胞间、肿瘤细胞与基质间通过信号传导来维持肿瘤的生长。传统二维细胞培养技术无法模拟肿瘤发生的形态学特点,但三维细胞培养技术能够通过在体外构建类似体内的细胞生长分化系统来对肿瘤细胞生长的微环境进行模拟,从而研究肿瘤恶性表型与肿瘤细胞所处环境的关系,进而随着技术的改进实现多种细胞共培养,达到更好模拟体内环境的目的。本文就近年来三维细胞培养技术的发展进行综述。
1 三维细胞培养技术
1885年德国人WillhelmRoux从鸡胚中分离细胞被认为是组织细胞培养技术的萌芽,而Harrison[1]在1907年以及Carrel[2]在1912年开始研究的离体动物细胞培养方法标志着现代细胞培养技术的诞生。在体外细胞培养技术发明和发展的这一百多年的时间,二维细胞培养技术已经具有培养简单、易操作、费用低等优点,但在很多时候通过二维培养得出的实验结果并不能在动物体内得到重复。科研人员认为,这种体外和体内实验结果差异的原因主要是由于二维培养的细胞虽能在体外增殖和分化,但其生长发育的环境和条件与体内差异较大,这就导致细胞的基因表达和形态特征与体内差异较大。为尽可能的模仿细胞在动物体内的生长环境并得到更加类似体内生长的细胞,三维细胞培养技术得到了越来越多的关注。
20世纪80年代,美国劳伦斯伯克利国家实验室的Mina Bissell和William Ole Peterson在对乳腺癌的研究中发明了三维细胞培养技术,他们发现,三维培养的正常的乳腺上皮细胞形成了腺泡状单层管状结构,同时,原癌基因激活的乳腺上皮细胞也形成了碗状腺泡结构(图1)。
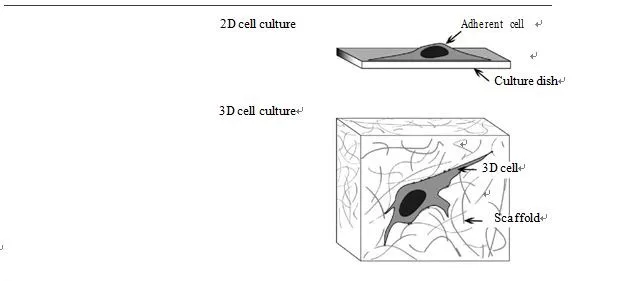
三维细胞培养技术是指将动物细胞与具有三维结构的支架材料共同培养,使细胞能够在三维立体空间生长、增殖和迁移,构成三维的细胞−细胞或细胞−载体复合物,从而更好地模拟细胞在体内的生长环境。在近30年的研究过程中,三维培养技术也得到了巨大的进步,目前三维培养技术主要分为需要支架的三维培养技术和不需要支架的三维细胞培养技术。细胞支架主要是在三维空间内构建供细胞附着和生长的类似脚手架的多孔结构,细胞依附于支架进行三维生长和迁移,主要的支架材料有胶原和水凝胶等,价格较为低廉且操作简单;而不需要支架的三维培养技术主要是通过物理方法使贴壁细胞悬浮于培养基中以达到三维培养的目的,目前主要的技术有微载体、磁悬浮、悬滴板和磁性三维生物印刷等技术,这类方法操作较为复杂,前期投入较大,目前绝大多数三维培养均借助于支架材料。近年来,三维细胞培养技术在肿瘤学、干细胞生物学和器官再造等领域得到了普遍的应用,同时很多研究者也关注到,在病毒监测、药物筛选和评估实验等方面,利用三维培养得出的结论与动物实验更加类似,因此研究三维细胞培养技术尤为重要。
2 三维细胞培养技术的优点
自首次建立体外细胞培养体系以来,二维细胞培养技术有了蓬勃的发展。但是,在一些情况下,二维细胞培养技术所取得的研究结果与体内的情况不吻合,在形态、结构和功能方面都与在体内自然生长的细胞相去甚远。麻省理工学院著名肿瘤学专家Weinberg等指出,应用二维培养方法研究恶性肿瘤细胞似乎有些怪异。而动物模型耗时、耗力且价格昂贵,我们通常在动物身上只观察到最终呈现的表现,却不能很好地探究其中的过程,同时动物实验涉及动物个体差异、免疫排斥等问题,不易控制,也不易得出普遍又准确的结论。三维细胞培养技术可利用模块化组织工程技术较好地模拟体内细胞生长环境,并凭借该技术得到更快的发展。
目前,已经有大量的实验证据表明,三维培养的细胞更适用于抗癌药物的筛选,更能够预测与肿瘤相关的机制。Chetty等[3]将肝癌细胞分别在二维和三维培养条件下进行药物处理,结果发现,肝癌细胞在三维培养体系中对药物的敏感性比二维条件下低,更接近于体内肿瘤细胞对药物的敏感性。Chitcholtan等[4]通过研究子宫内膜细胞分别在二维和三维培养条件下的生长模式、信号分子的表达及代谢情况,发现三维培养体系明显优于二维培养体系。Leslie等[5]的研究发现,使用三维培养技术传代培养乳腺上皮细胞可以观察IL-6的分泌,并可以激活STAT3通路;同时,在异种移植物和人类肿瘤中也证明了这一现象确实存在,而在二维培养条件下,却不能得出同样的结论。Tit-Oon等[6]的研究结果表明,生长在三维环境中的胆囊癌细胞比生长在二维环境中的细胞形态变化更加显著,而且能够增强细胞外基质的沉积,能够分泌更多的蛋白,有利于更好地研究胆囊癌形成的机制。
综上所述,三维细胞培养更加灵活、简单、安全和可控,比二维培养有更多的优势。目前,三维细胞培养技术在细胞传代、细胞复苏、细胞冻存等方面都已经取得了很大的进展。为此,从不同的研究需求出发,建立更接近细胞生存环境的三维细胞培养模型体系以对细胞进行更好的培养,就显得格外重要了。
3 三维细胞培养技术的支架材料
由于支架材料具有价格低廉和操作简便的优势,绝大多数的科研人员都以支架材料为手段对三维培养进行研究。三维培养支架材料可分为天然细胞外基质和人造基质,是组织工程学研究中最重要的内容之一。研究表明,支架材料本身的结构特性和表面活性可为细胞提供用于生长依附的空间架构,同时能够协调生物活性因子和细胞之间的相互作用,增进细胞之间的黏附,促使细胞的基因表达、分泌,使细胞的功能活动更接近于体内。理想的生物支架材料应具备以下特点:良好的组织相容性、无毒性、可降解、硬度好、多孔性、可渗性好、弹性好等。常用的三维细胞培养支架材料有天然生物材料、人工合成高分子材料等。
3.1 天然高分子材料
天然高分子材料来源于动物或人体,其网状结构、成分、生物力学环境适合细胞的增殖、黏附及新陈代谢,而且该种材料抗原性低、无毒性、可降解、能促进细胞生长和黏附,因此越来越受到研究者的重视。天然高分子材料主要包括胶原、Matrigel、壳聚糖、明胶等。
3.1.1 胶原是人体中含量较高、白色透明、无分支的原纤维,在动物的皮肤、骨、软骨、牙齿、肌脾韧带和血管中有较高的表达。胶原具有良好的酶和细胞亲和性,可吸收并结合多种酶和细胞,使其固定化。同时胶原的免疫排斥反应小,力学性能高,能够促进细胞生长,具有较高的生物相容性和生物降解性。目前,胶原凭借其独特的优势以水凝胶的形式作为三维细胞培养的普遍支架材料。胶原凝胶是含水的凝胶,营养物可以自由进出凝胶网络,使分散于网络中的细胞都能得到营养,并易于添加各种生长因子,有利于细胞的黏附、增殖和分化。总之胶原是最具前景的一项生物材料,已广泛的应用于心肌、肝脏等人体组织器官的工程化组织构建。Luo等[7]在牛肌腱复合胶原上培养人牙周膜成纤维细胞(human periodontal ligament fibroblasts, HPDLFs),结果发现,牛肌腱复合胶原明显增强HPDLFs的增殖,且HPDLFs细胞间的黏附能力有所提高,证明了牛肌腱复合胶原具有良好的生物相容性,可作为支架材料应用于牙周组织工程研究。Meng等[8]研究表明,以胶原、明胶水凝胶为支架构建的三维培养系统能够更好地模拟肝脏组织结构,并能在更长时间内保证肝细胞进行生长、分裂、代谢等各种复杂的功能。
3.1.2Matrigel是从富含胞外基质蛋白的Engelbreth-Holm-Swarm(EHS)小鼠肿瘤中分离出来的重组基质成分。Matrigel的主要成分是层黏连蛋白(laminin),一种可溶性的大分子糖蛋白,分布在细胞外基质中,其分子上存在某些细胞表面黏附分子的结合位点,以此促进细胞的黏附、生长与分化。Matrigel中还含有IV型胶原、硫酸乙酰肝素、蛋白多糖、内功素、转化生长因子-β(transforminggrowth factor-β,TGF-β)和胰岛素样生长因子-1(insulin-like growth factors-1, IGF-1)等多种细胞外基质、蛋白酶和生长因子成分,均能参与调节细胞的生长、分化、迁移及组织形成。因此,Matrigel比单一细胞外基质成分更能发挥生物学作用,更接近在体细胞生长的微环境,是理想的体外培养平台。近年来,Matrigel凭借其具有稳定的增殖率、高端粒酶活性、可以通过诱导细胞表达必要的蛋白质,从而促进细胞之间更好的连接等优点,用于构建适于细胞生长的三维立体支架。
目前,Matrigel在胚胎发育、肿瘤学研究、组织损伤后修复过程中均发挥着重要的作用。Li等[9]在Matrigel上培养人汗腺上皮细胞,结果发现,Matrigel能够促进上皮细胞分化成汗腺组织,表明Matrigel可以作为组织工程的支架材料。
3.2 人工合成高分子材料
人工合成高分子材料主要包括聚乳酸、聚乙醇酸及其共聚物、聚己内酯等脂肪族聚酯等。相对于天然材料,更利于进行标准化的生产,其具有良好的可塑性,可以加工成各种实验所需要的结构形状。但是人工合成高分子材料亲水性差、对细胞的黏附性较弱,易引发无菌性炎症,因此在某些方面还有待于进一步改进。
3.2.1 聚乳酸(polylacticacid,PLA)是将天然农作物所提取的淀粉原料进行发酵、人工化学合成等一系列方法得到的一种全新形态的生物降解塑料。PLA不仅具备良好的生物降解和生物相容性、可吸收性及可降解性,而且它还具有机械强度高、化学稳定性好等优点,成为了最具竞争力的生物材料,广泛应用于缝线、支架、医药和农业等领域。但是PLA疏水性较强,成骨性能不理想,降解产物偏酸性,在体内易引起无菌性炎症,从而不利于细胞的黏附和增殖,因而限制了其应用,所以PLA需要与其他材料复合后方可达到较好的效果。Man等[10]利用聚乙二醇单甲醚−聚乳酸(methoxypolyethyleneglycol-polylactic acid,MPEG-PLA)包裹齐墩果酸(oleanolic acid,OA),以解决OA疏水性和水溶性差而不能达到抗癌药性的缺陷,结果表明,MPEG-PLA共聚物是口服致癌药物载体的最佳选择。Llorens等[11]制备了含有聚六亚甲基双胍(polyhexamethylenebiguanide hydrochloride,PHMB)的PLA纳米纤维,并用该材料作为生物支架材料三维培养成纤维细胞和上皮细胞,结果发现,与二维培养相比,三维培养的细胞具有更好的增殖活性和黏附能力。
3.2.2聚己内酯(polycaprolactone,PCL)是由ε-己内酯开环聚合所得的线性脂肪族聚酯。自20世纪60年代以来,PCL具有良好的药物透过性、力学性能、生物相容性、低毒性、易于加工等优势,并有利于细胞的生长、繁殖,因此其研制与开发日益受到人们的重视。目前,PCL已经获得美国FDA的批准,在生物医学、组织工程支架、药学材料等领域得到越来越广泛的应用然而,PCL仍存在亲水性差、熔点及分解温度低、成型工艺复杂、强度不高等缺点,所以需要与其他材料复合使用。
4 三维细胞培养技术的发展前景
三维细胞培养技术对于细胞生长、分化以及细胞间相互作用机制的研究具有巨大的意义,同时将会有更多的应用价值被发掘。在支架材料、操作方法和抗肿瘤药物筛选及组织工程应用等方面三维细胞培养基础都取得了一定的成就。但是三维细胞培养技术的发展还面临许多困难,如细胞在三维培养体系中未达到最好的生长状态,与体内的真实情况还有一定的差别;支架材料的选择、辅助的培养方式等不够完善等。相信随着三维细胞培养技术与微流控、微制造、微芯片等前沿技术的融合以及相关学科的发展,这些问题将会逐一解决。三维细胞培养技术在肿瘤学、干细胞生物学、组织形成、血管发育、器官再造等领域的应用将会取得巨大的成就,是目前值得深入研究的课题。
参考文献 (References)
1.Ross HG. Embryonictransplantation and development of the nervous system. Anat Rec (Hoboken) 1908;2(9): 385-410.
2.Carrel A, IngebrigtsenR. The production of antibody by tissues living outside of the organism. J ExpMed 1912; 15(3): 287-91.
3.Chetty AS, VarghaV, Maity A, Moolman FS, Rossouw C, Anandjiwala R, et al. Development of thermoresponsive poly(propylene-g-N-isopropylacrylamide) non-woven 3D scaffold for smart cellculture using oxyfluorination-assisted graft polymerisation. Colloids Surf APhysicochem Eng Asp 2013; 419: 37-45.
4.Chitcholtan K, Asselin E, Parent S,Sykes PH, Evans JJ.Differencesin growth properties of endometrial cancer in three dimensional (3D) cultureand 2D cell monolayer. Exp Cell Res 2013; 319(1): 75-87.
5.LeslieK, Gao SP, Berishaj M, Podsypanina K, Ho H, Ivashkiv L, et al. Differential interleukin-6/Stat3 signaling as a functionof cellular context mediates Ras-induced transformation. Breast Cancer Res2010; 12(5): R80.
6.Tit- Oon P, Chokchaichamnankit D, Khongmanee A, Sawangareetrakul P, Svasti J,Srisomsap C. Comparative secretome analysis of cholangiocarcinoma cell line in three-dimensionalculture. Int J Oncol 2014; 45(5): 2108-16.
7.骆 凯, 闫福华, 金 岩, 刘 源, 王新文. 牛肌腱复合胶原与人牙周膜成纤维细胞培养的实验研究. 中国修复重建外科杂志(LuoKai, Yan Fuhua, Jin Yan, Liu Yuan, Wang Xinwen. Biocompatibility study ontendon mixed extraction of bovine collagen for periodontal tissue engineering.Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi) 2005; 19(3): 234-7.
8.MengQ, Tao C, Qiu Z, Akaike T, Cui F, Wang X. A hybrid substratum for primaryhepatocyte culture that enhances hepatic functionality with low serum dependency.Int J Nanomedicine 2015; 10: 2313-23.
9.LiH, Chen L, Zhang M, Tang S, Fu X. Three-dimensional culture and identificationof human eccrine sweat glands in matrigel basement membrane matrix. Cell TissueRes 2013; 354(3): 897-902.
10.Man DK, CasettariL, Cespi M, Bonacucina G, Palmieri GF, Sze SC, et al. Oleanolic acid-loaded PEGylated PLA and PLGAnanoparticles with enhanced cytotoxic activity against cancer cells. Mol Pharm2015; 12(6): 2112-25.
11.Llorens E, CalderonS, Del VL, Puiggali J. Polybiguanide (PHMB) loaded in PLA scaffolds displayinghigh hydrophobic, biocompatibility and antibacterial properties. Mater Sci EngC Mater Biol Appl 2015; 50: 74-84.
注:本文引用赵典典、侯玲玲、张婧思、胡红刚、晏琼《三维细胞培养技术的发展及其在干细胞和肿瘤细胞中的应用》
咨询
- 302
- 点赞
- 复制链接
- 举报