客户论文分享(2)▎都在关注的肿瘤免疫治疗,又双叒有新发现!
IF = 18.027 | 线粒体靶向药物致骨肉瘤焦变性以增强骨肉瘤免疫治疗
骨肉瘤(OS)是最常见的具有免疫抑制肿瘤微环境(TME)的恶性骨肿瘤。 采用辅助化疗和新辅助化疗治疗骨肉瘤,大大提高了骨肉瘤患者的生存期。 先前的一项研究表明,焦亡能显著诱导抗肿瘤反应并抑制肿瘤生长。许多细胞外刺激可以诱导癌细胞的焦变性,包括小分子抑制剂(BRAFi和MEKi),化疗药物(索拉非尼,洛铂和环己亚胺),以及CAR-T细胞释放的细胞溶解细胞因子。然而,复杂的机制和快速的清除限制了这些药物用于诱导焦亡。 成功诱导焦亡作为一种治疗策略仍然是一个挑战。
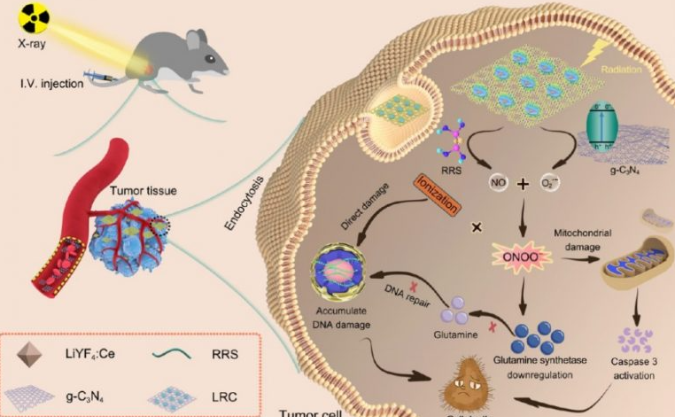
近日,来自浙江大学医学院附属第二医院的研究团队在期刊ACS NANO上发表了题为:Mitochondria-Targeting Polymer Micelle of Dichloroacetate Induced Pyroptosis to Enhance Osteosarcoma Immunotherapy的研究论文。他们首次阑明OPDEA-PDCA联合抗PD - L1单克隆抗体可显著抑制骨肉瘤的增殖,延长T细胞活化时间。
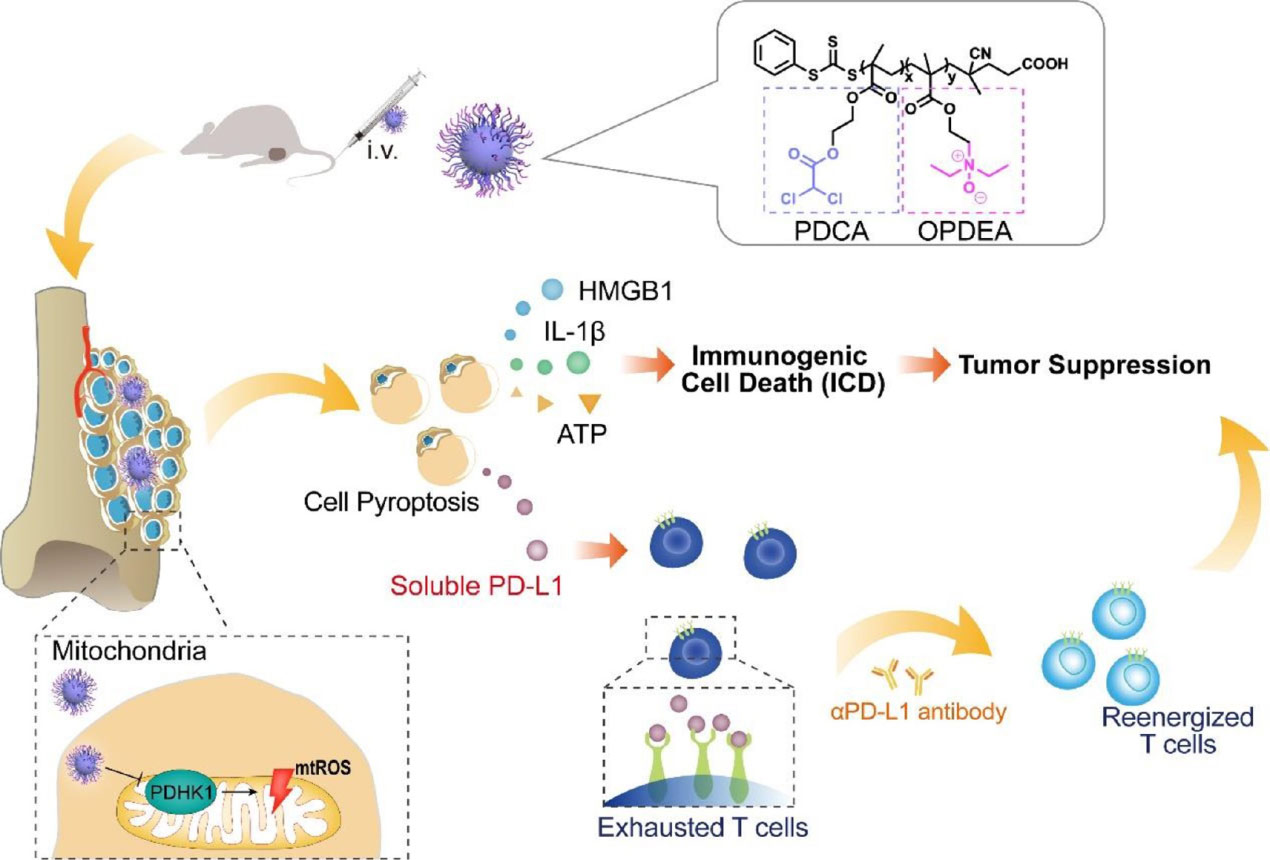
该团队合成了一种线粒体靶向聚合物胶束(OPDEA- PDCA),利用聚[2-(n -氧化物- n, n -二乙基氨基)甲基丙烯酸乙酯](OPDEA)靶向线粒体,并用共轭二氯乙酸(DCA)抑制丙酮酸脱氢酶激酶1 (PDHK1)。这种结合物通过启动线粒体氧化应激诱导焦亡。发现OPDEA-PDCA靶向线粒体,通过抑制PDHK1诱导线粒体氧化应激,导致骨肉瘤细胞系的免疫原性焦变性。此外,他们发现OPDEA-PDCA可以诱导可溶性程序性细胞死亡配体1 (PD-L1)分子的分泌。本研究提供了一种通过靶向调控线粒体启动焦亡的策略,有望与免疫治疗联合提高抗肿瘤疗效。
《《《《《《《 MULTISCIENCES产品支撑 》》》》》》》

IF = 15.153 | 弹性纳米疫苗增强树突状细胞介导的肿瘤免疫治疗
以树突状细胞(DCs)为基础的疫苗是一种已获批准且有前景的免疫治疗方法,它利用患者的免疫系统潜能消除肿瘤细胞。
近年来,纳米疫苗因其与传统疫苗相比具有的诸多优势以及提高疫苗接种效果的潜力而受到越来越多的关注。纳米佐剂递送抗原有利于保护负载抗原不被降解,降低抗原剂量,促进疫苗接种级联效应,延长接种效果,塑造免疫表型。因此,基于纳米疫苗的免疫治疗(Nanovaccine-based immunotherapy, NBI)是新一代肿瘤疫苗治疗不可或缺的组成部分,在增强抗原特异性免疫应答方面发挥着重要作用。但目前,纳米颗粒的弹性特性是否会影响肿瘤疫苗接种级联以及NBI的免疫治疗效果还没有明确的定论。

最近,南京大学医学院的研究团队在期刊Small上发表了题为Elastic Nanovaccine Enhances Dendritic Cell-Mediated Tumor Immunotherapy的研究论文。该团队的研究表明,纳米颗粒的弹性对DCs介导的肿瘤免疫至关重要,弹性NBI软介孔有机硅纳米疫苗(SMONV)可诱导强大的抗肿瘤免疫,在DCs介导的抗肿瘤免疫治疗中具有很大的潜力。
这项研究发现,弹性SMONV在有效激活DCs介导的抗肿瘤免疫方面具有优势。纳米颗粒的弹性,使SMONV被DCs内化后更有效地促进抗原的内体逃逸。SMONV能向细胞内传递和释放足够的抗原,并能诱发更强的抗原交叉呈递。而且,SMONV展现出优越的淋巴引流能力,从而激活抗原特异性CD8+ T细胞免疫应答。此外,肿瘤模型小鼠皮下接种SMONV表现出较低的免疫抑制效应和显著的免疫记忆效应。因此,弹性纳米疫苗在肿瘤免疫治疗领域拥有广阔的应用前景。

咨询
- 336
- 点赞
- 复制链接
- 举报